
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД ТЕМПЕРАТУРИ
Крім концентрації реагуючих речовин іншим важливим фактором, що впливає на швидкість реакції, є температура. З підвищення температури швидкість хімічних реакцій збільшується. При підвищенні температури зростає швидкість руху молекул і, відповідно, збільшується кількість зіткнень між ними. Тому, чим вище температура, тим більша швидкість реакції. Однак розрахунки показують, що при підвищенні температури на 1000С кількість зіткнень між молекулами збільшується тільки в 1,2 рази, в той час, як швидкість зростає більше ніж в тисячу разів. Тому збільшення числа зіткнень між молекулами не є головною причиною такого значного збільшення швидкості реакції при нагріванні.
З рівняння (4.2) видно, що в цьому випадку збільшення пов’язано із збільшенням К, бо концентрація речовин від Т не залежить. Якщо позначити черезКт, константу швидкості реакції при температурі Т, а через Кт+10 константу швидкості при Т на 100 С більшій, то відношення цих констант буде дорівнювати температурному коефіцієнту швидкості реакції γ: γ = Кт +10
Кт
Значення коефіцієнту γ коливається в межах від 2 до 4.
При підвищенні температури на 100С швидкість хімічної реакції збільшується в 2- 4 рази. Це є правило Вант – Гоффа. Якщо прийняти, що температурний коефіцієнт γ = 2, то при нагріванні реагуючих речовин від 20 до 1000С швидкість реакції збільшиться в 256 разів:
Кт +80
γ =2; γ = Кт = 28 = 256.
Таким чином, збільшення температури в арифметичній прогресії приводить до збільшення швидкості реакції в геометричній прогресії.
Правило Вант – Гоффа наближене і може застосовуватися до реакцій, що протікають при температурі від 00 до 3000С і в невеликому температурному інтервалі.
З підвищенням температури температурний коефіцієнт швидкості реакцій зменшується, наближаючись до 1.
Більш точна залежність швидкості хімічної реакції (константи швидкості) від температури Т експериментально встановлена Арреніусом (швецьким фізикохіміком, лауреатом Нобелевської премії).
ℓn  К = B -
К = B - 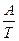 , де А і В – постійні для даної реакції.
, де А і В – постійні для даної реакції.
Заслуга С.Арреніуса полягає не лише в тому, що він знайшов залежність швидкості реакції від температури. Він пояснив природу цієї залежності, показавши, що далеко не кожне зіткнення двох молекул веде до хімічної взаємодії. Якби всі зіткнення молекул у газовій фазі закінчувались хімічною взаємодією, такі реакції протікали б зі швидкістю вибуху.
Щоб зруйнувалися старі зв’язки й утворилася нова речовина, молекули повинні мати надлишкову енергію, що називається енергією активації даної реакції. Молекули, які мають таку енергію, називаються активними молекулами. При підвищенні температури різко збільшується число активних часток.
Енергія активації – надлишок енергії, яку повинні мати молекули (частинки) реагуючих речовин, щоб перетворитися на активні.
Таке пояснення природне, тому що реакції повинні передувати ослаблення та руйнування хімічних зв’язків у реагуючих молекулах, на що потрібна витрата енергії. Величина енергії активізації визначається природою реагуючих речовин. Отже, з підвищенням температури енергія активації залишається постійною, проте зростає число молекул, що мають необхідний запас енергії.
Тільки активні молекули, що мають у момент зіткнення необхідний надлишок енергії, можуть подолати енергетичний бар’єр і вступити у хімічну взаємодію. Число їх тим більше, чим менша величина енергетичного бар’єра.
Звичайно енергія активації у 3-5 разів менша енергії розриву хімічних зв’язків. Це означає, що для проходження реакції не потрібно повністю руйнувати старі молекули, а досить їх лише активувати, послабити хімічні зв’язки між атомами.
Теорія активних зіткнень Арреніуса має такий істотний недолік – вона не враховує час, необхідний для перерозподілу зв’язків і утворення нових молекул.
Вплив температури на швидкість біохімічних процесів має більш складний характер. З підвищенням температури швидкість цих процесів також збільшується, але до певної температурної межі, вище якої швидкість процесу різко зменшується.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Абсолютні і відносні швидкості
- Автокореляція залишків – це залежність між послідовними значеннями стохастичної складової моделі.
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Алгоритм розрахунку температури поверхні чипу ІМС процесора
- Аналіз впливу зміни температури довкілля і термо-залежного параметру на величину відхилення часових інтервалів
- Аналіз статистичних залежностей періодичних відліків часу ПФС від температури
- Аналітичні реакції (реактиви)
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антиген - це полімер органічної природи, генетично чужерідний для макроорганізма, при потраплянні в який викликає імунні реакції, що направлені на його видалення.
- Антигени. Антитіла. Серологічні реакції .
| <== попередня сторінка | | | наступна сторінка ==> |
| Для гетерогенних реакцій швидкіть прямопропорційна площі поверхні реагуючих речовин. | | | СКЛАДНІ РЕАКЦІЇ. ЛАНЦЮГОВІ РЕАКЦІЇ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |