
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лабораторна робота № 8
Тема роботи: Реакції діазотування та азосполучення.
Мета роботи: Синтез метилоранжу.
При виконанні роботи потрібно синтезувати речовину, навчитись проводити діазотування та азосполучення, працювати з речовинами, що розкладаються, готувати розчини певних концентрацій, освоїти прийоми роботи з охолоджувальними сумішами, навчитись виділяти та перекристалізовувати речовину.
Тривалість виконання: 4 год.
І. Теоретична частина
Метилоранж (інші назви: натрієва сіль п-N,N-диметиламінофеніл-азобензол-4-сульфокислоти, геліантин, метиловий оранжевий) є азобарвником –індикатором. У кислому середовищі метилоранж має червоний колір, в лужному – жовто-оранжевий.
Азобарвники отримують реакцією азосполучення. Це реакція електрофільного заміщення, де електрофілом є діазокатіон, що входить до складу солі діазонію. Діазокатіон слабкий електрофіл і здатний реагувати тільки з активними в реакціях SE ароматичними сполуками – фенолами та ароматичними амінами.
Оскільки солі діазонію нестійкі (при підвищенні температури розкладаються з виділенням азоту), їх не виділяють з водних розчинів, і використовують ці розчини для проведення певних хімічних перетворень. Очевидно, що синтез будь-якого азобарвника складається з двох послідовних стадій: отримання солі діазонію (реакція діазотування) і подальшої її взаємодії з ароматичними фенолами чи амінами (реакції азосполучення).
Солі діазонію добувають з первинних ароматичних амінів при дії азотистої (нітритної) кислоти при наявності мінеральної кислоти при низьких температурах (0-5°С). Азотиста кислота нестійка, тому її отримують безпосередньо в реакційному середовищі з NaNO2 i HCl. Наприклад, з аніліну при діазотуванні утворюється фенілдіазоній хлорид.

Фенілдіазоній хлорид
Реакція діазотування відбувається за наступним механізмом.
Азотиста кислота в реакції діазотування малоактивна, але при дії протона мінеральної кислоти вона утворює активний катіон:
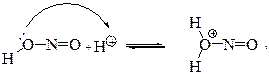 |
при розкладі якого утворюється надзвичайно активний діазотуючий реагент – нітрозоній-катіон:

Генерований нітрозоній-катіон вступає у реакцію з первинним аміном:

Швидкість реакції діазотування (реакція електрофільного заміщення атомів водню біля атома азоту) залежить від основності аміну, тобто від здатності вільної пари електронів азоту взаємодіяти з електрофільним реагентом діазотування і буде тим більша, чим вища основність аміну.
У реакцію діазотування вступає тільки вільна аміногрупа, виділення якої із солі у кислому середовищі відбувається за рахунок гідролізу:
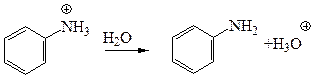
Солі діазонію існують у кислому середовищі. При підвищенні рН, тобто при збільшенні концентрації гідроксил-іона вони перетворюються у діазогідрат, який швидко реагує з лугом як кислота, утворюючи діазотат-аніон. Одже, залежно від рН середовища можуть існувати різні форми діазосполук:
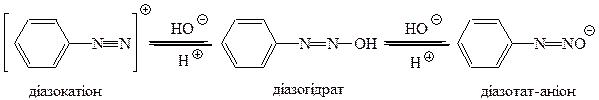
Для солей діазонію характерні ракції з виділенням азоту:
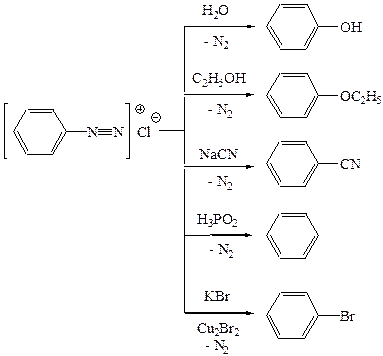
Ці реакції можут застосовуватись для введення функціональних груп у бензольне кільце.
Одна із найважливіших реакцій без виділення азоту є реакція азосполучення солей діазонію з активними ароматичними сполуками (амінами, фенолами тощо).
У реакції азосполучення беруть участь два реагенти – сіль діазонію (діазокомпонент) і ароматична сполука з електронодонорним замісником (азокомпонент). За своїм механізмом реакція азосполучення є звичайною реакцією електрофільного заміщення в ароматичному ядрі, у якій електрофілом є діазокатіон:
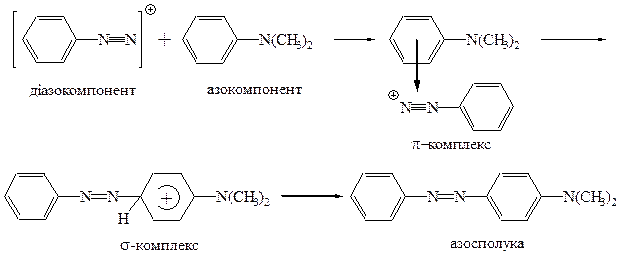
В реакції як діазокомпонент бере участь тільки діазокатіон, інші форми діазосполук – не активні. Електроноакцепторні групи (особливо в о- і n-положеннях), що присутні в діазокомпоненті, збільшують позитивний заряд на нітрогені і прискорюють реакцію. Електронодонорні групи заповільнюють реакцію
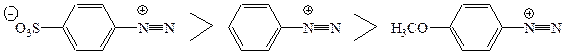 |
азосполучення:
З іншого боку, швидкість азосполучення збільшується при підвищенні електронної густини на атомі карбону азокомпонента, який атакується діазокатіоном. Тому фенолят-іон значно активніший в реакції азосполучення, ніж фенол:
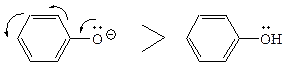
Аміногрупа може змістити свою електронну пару на ароматичне ядро тільки у тому випадку, коли вона знаходиться у вільному стані, а не у вигляді солі. Тому активність азокомпонента значно залежить від кислотності середовища. До того ж, як зазначалось вище, концентрація діазокатіона також значно залежить від рН середовища. Тому для реакцій азосполучення існують оптимальні умови кислотності середовища. Сполучення з амінами проводять у слабокислому або нейтральному середовищі (у сильнокислому середовищі сполучення не відбувається через невелику концентрацію вільного аміну). Сполучення з фенолами відбувається краще у слабколужному середовищі (концентрація фенолят-іона вже велика, а утворення діазотат-іона ще незначне). Сполучення відбувається переважно в n-положення азокомпонента, а якщо це положення зайняте, то в о-положення азоскладової. У нафтолів атакується звичайно α-положення, яке має більшу електронну густину.
Наявність в азосполуках як хромоформних групп, -N=N–, так і ауксохромів –ОН, -NH2 робить азосполуки барвниками. Деякі з них є індикаторами, оскільки при зміні рН середовища виникають нові хромоформні групи, і це викликає зміну забарвлення. Наприклад, метилоранж має інтервал переходу забарвлення від червоного до жовто-оранжевого при рН = 3,0 –4,4.
Синтез метилоранжу полягає в діазотуванні солі сульфанілової кислоти з подальшим азосполученням отриманої солі (діазокомпонент) з N,N- диметиланіліном ( азокомпонент).
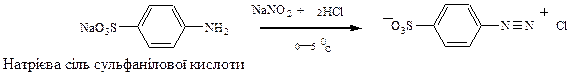
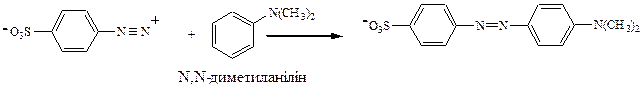
Оскільки азокомпонентом є амін, то реакцію азосполучення проводять у слабокисломусередовищі (у сильнокислому середовищі азосполучення не відбувається через невелику концентрацію вільного аміну, у цих умовах амін перебуватиме в основному у вигляді солі).
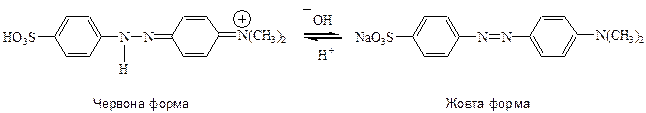
У кислому середовищі метилоранж набуває червоного кольору унаслідок протонізації –N=N- групи більш основнішої, ніж -N(CH3)2. Виникає хіноїдна
структура з іншим перерозподілом електронної густини у спряженій системі, що супроводжується зміною кольору.
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- II. Самостійна робота студентів.
- IV. ВИХОВНА РОБОТА В КЛАСІ
- IV. ІНДИВІДУАЛЬНА РОБОТА СТУДЕНТІВ.
- IV. Науково-дослідницька робота.
- IV. Практична робота.
- IV. Робота над темою уроку
- Qорганізаційне середовище, в якому виконується робота
- V. Робота з підручником
- V. Робота з підручником. с. 59-60
- V. Робота з програмою «Виконавець Восьминіжка»
- V. Робота з програмою «Виконавець Садівник».
| <== попередня сторінка | | | наступна сторінка ==> |
| Техніка безпеки | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |