
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фізичні та хімічні властивості спиртів та фенолів
За систематичною номенклатурою назви спиртів утворюють, додаючи до назви відповідного вуглеводню суфікс – ол. Якщо молекула містить декілька гідроксильних груп, то до назви додають суфікси – діол, – триол ... Нумерацію вуглецевого радикалу починають з атома карбону, який найближче розташований до гідроксильної групи, а місце розміщення гідроксилу позначають локантом, наприклад:

Найпростіша ароматична сполука, що містить гідроксил має тривіальну назвау фенол.
Насичені одноатомні спирти нерозгалуженої будови, які містять від 1 до 11 вуглецевих атомів, за нормальних умов – рідини. Вищі спирти, починаючи з С12, – тверді речовини. Фенол також є твердою речовиною, яка має специфічний запах. Температури кипіння спиртів є значно вищими, ніж температури кипіння вуглеводнів або галогенпохідних, що мають таку ж саму кількість вуглецевих атомів. Це пояснюється асоциацією молекул спирту, внаслідок утворення міжмолекулярних водневих зв’язків.
Здатність спиртів відщеплювати протон від гідроксильної групи виявляє кислотні властивості спиртів, а здатність приєднувати протон до неподіленої електронної пари О – атома виявляє тим самим основні властивості, тобто спирти мають амфотернівластивості.
Спирти реагують з лужними металами з утворенням солей – алкоголятів:
2 R – OH + 2 Na ® 2 R – ONa + H2.
Алкоголяти легко розкладаються водою:
H3C – CH2 – ONa + Н2О ® CH3 – CH2 – CH2OH + NaOH.
Кислотні властивості гліколів (двоатомних спиртів) більші за кислотні властивості одноатомних спиртів через те, що, внаслідок негативного індукційного ефекту (-І) одна гідроксильна група відтягує від іншої електронну густину, тому й гліколі взаємодіють не тільки з лужними металами, але й з лугами з утворенням солей – гліколятів.

Кислотні властивості гліцерину виражені ще сильніше, ніж в одно– та двохатомних спиртів.
За наявності водовіднімаючих засобів спирти реагують з галогеноводнями з утворенням галогенідів:
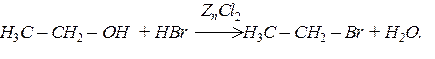
Спирти реагують з мінеральними та органічними кислотами. Продуктами такої взаємодії є відповідні естери:
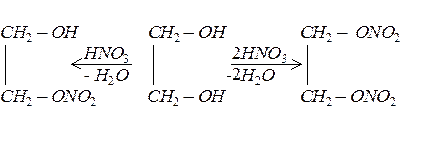
Багатоатомні спирти утворюють з кислотами повні або неповні естери. Наприклад, гліцерин взаємодіє з вищими карбоновими кислотами з утворенням тригліцеридів (жирів). Склад та будову жирів можна позначити загальною формулою:

де R – радикали вищих насичених і ненасичених монокарбоновихкислот, наприклад, стеаринової, олеїнової (масло оливи), ліноленової (льняна олія). У природних жирах залишки кислот мають, головним чином, нерозгалужений вуглецевий ланцюг та парну кількість вуглецевих атомів. Гліцериди ненасичених високомолекулярних кислот за певних умов здатні до самозаймання. Згідно з пероксидною теорією А.Н.Баха, такі речовини окислюються киснем повітря за місцем подвійного зв’язку з утворенням пероксидів. Така реакція супроводжується виділенням тепла. Пероксиди, що утворилися, здатні до подальших перетворень, в тому числі до полімеризації. Такі реакції супроводжуються виділенням тепла. До основних умов самозаймання жирів відносяться: великій вміст подвійних зв’язків в залишках карбонових кислот, наявність великий поверхні окислення і малої поверхні тепловіддачі, доступ повітря, температура навколишнього середовища не менше 10 0С, певна щільність промасленого матеріалу.
Кількість подвійних зв’язків можна визначити за допомогою йодометричного методу. Цей метод засновано на здатності галогенів приєднуватися за місцем подвійного зв’язку. За кількістю йоду, що прореагував, можна судити про ступінь ненасиченості сполуки. Критерієм такої оцінки може служити йодне число (Іч), яке показує, скільки грамів йоду приєднується в певних умовах до 100 грамів масла. Якщо Іч< 50 – масло не схильне до самозаймання, а якщо Іч > 50 – схильне.
При дії водовіднімаючих засобів, в залежності від умов, спирти можуть утворювати прості ефіри (етери) або ненасичені сполуки:

Одноатомні спирти окиснюються за кімнатної температури такими окисниками як KMnO4 та хромова суміш. Первинні спирти окислюються до альдегідів:
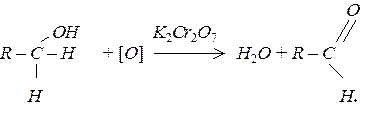
Вторинні спирти при окисленні перетворюються на кетони:

Спирти мають більшу, порівняно з насиченими вуглеводнями, схильність до самозаймання при контакті з сильними окисниками. Полум’я при горінні нижчих спиртів світиться слабко, кіптява не утворюється.
Приклад 51.
Яку кількість етилацетату можна добути з 23 г етанолу і 12 г оцтової кислоти?
Розв'язання.
1. Етилацетат можна добути за реакцією:
CH3–C=O + C2H5OH ® CH3–C=O + H2O.
½ ½
OH O–C2H5
2. Для визначення, яка з реагуючих речовин в надлишку, розрахуємо кількість реагентів:
n(етанолу)=m/M=23/46=0.5 моль ; n(кислоти)=m/M=12/60=0.2 моль.
Етанол знаходиться в надлишку. Розрахунки робимо за оцтовою кислотою.
3. З рівняння реакції бачимо, що з 1 моля кислоти утворюється 1 моль ефіру. Кислоти маємо 0,2 моль, тобто ефіру утвориться теж 0,2 моль.
m(ефіру)=п(ефіру)´М(ефіру)=0,2´88=17,6 г.
Приклад 52.
В чому полягає особливість окиснення третинних спиртів?
Розв'язання.
Первинні та вторинні спирти окиснюються без руйнування вулецевого ланцюга, при цьому утворюються відповідно альдегіди та кетони. Третинні спирти окиснюються значно важче з руйнуванням вулецевого ланцюга і утворенням суміші кислоти і кетону:

Феноли мають більш виражені кислотні властивості, ніж дво- та трьохатомні спирти.
Для фенолів також характерні реакції електрофільного (Se) заміщення по бензеновому кільцю, наприклад, нітрування:

Читайте також:
- I. Фізичні основи механіки
- OПТИЧНІ ВЛАСТИВОСТІ КОЛОЇДНИХ СИСТЕМ
- А) Товар і його властивості.
- А/. Фізичні особи як суб’єкти цивільного права.
- Аеродинамічні властивості колісної машини
- Алкани (насичені вуглеводні). Хімічні властивості алканів
- Алкани, їх хімічні властивості.
- Алкени. Хімічні властивості
- Алкіни. Хімічні властивості
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
| <== попередня сторінка | | | наступна сторінка ==> |
| Загальна характеристика кисневмісних сполук | | | Властивості альдегідів і кетонів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |