
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Підібрати коефіцієнти у схемі окисно-відновної реакції
Р + HNO3 + H2O ® H3PO4 + NO.
Наведена реакція є прикладом міжмолекулярної окисно-відновної реакції. Окисник і відновник – елементи різних молекул.
Позначимо ступені окиснення всіх елементів:
0 +1+5-2 +1 -2 +1 +5 -2 +2 -2
Р + HNO3 + H2O ® H3PO4 + NO.
Ступінь окиснення змінили Фосфор та Нітроґен. Фосфор віддає електрони, ступінь його окиснення підвищується з 0 до (+5), він – відновник.
Нітроґен приймає 3 електрони, змінюючи ступінь окиснення з (+5) до (+2).
Нітратна кислота – окисник.
Для знаходження основних коефіцієнтів застосовують схему електронного балансу. В її основу покладене припущення про те, що кількість електронів, яку віддає відновник, повинна дорівнювати кількості електронів, приєднаних окисником.
Схему електронного балансу записують так:


 Р0 –5е ® Р+5 5 3
Р0 –5е ® Р+5 5 3
N+5 +3е ® N+2 3 5
Щоб кількість електронів, які приєднує окисник, дорівнювала кількості електронів, що віддає відновник, треба знайти найменше спільне кратне цих двох чисел (для 5 і 3 − це 15, а основними коефіцієнтами будуть 3 для Фосфору і 5 для Нітроґену).
Підставимо коефіцієнти у схему:
0 +5 +5 +2
3 Р + 5HNO3 + Н2O ® 3H3PO4 + 5NO.
Тепер треба підрахувати кількість атомів Гідрогену в лівій і правій частинах схеми реакції. Ця кількість неоднакова, але не можна змінювати коефіцієнти перед окисником чи відновником, бо це порушить електронний баланс. Тому кількість атомів гідрогену треба зробити однаковою, поставивши коефіцієнт 2 перед формулою води.
Остаточно рівняння реакції матиме такий вигляд:
3Р + 5HNO3 + 2Н2O = 3H3PO4 + 5NO.
Правильність написання рівняння підтверджується підрахунком числа атомів Оксигену: у лівій частині рівняння їх 5∙3 + 2×1 = 17; у правій −
3∙4 + 5∙1 = 17. Отже, рівняння складене правильно.
3. Підібрати коефіцієнти у схемі окисно-відновної реакції
KMnO4 + Na2SO3 + H2SO4 ® MnSO4 + Na2SO4 + K2SO4 + H2O.
Зазначимо ступені окиснення всіх елементів:
+1 +7 -2 +1 +4 –2 +1 +6 –2 +2 +6 –2 +1 +6 –2 +1+6 –2 +1 –2
KMnO4 + Na2SO3 + H2SO4 ® MnSO4 + Na2SO4 + K2SO4 + H2O.
Ступінь окиснення змінили Манґан та Сульфур. Манґан приймає 5 елек-тронів, змінюючи ступінь окиснення з (+7) до (+2). KMnO4 - окисник. Сульфур віддає 2 електрони, ступінь його окиснення підвищується з (+4) до (+6). Na2SO3 − відновник.
Ці зміни можна виразити електронними рівняннями:



Mn+7 +5е ® Mn+2 5 2
S+4 - 2е ® S+6 2 5
Підставимо коефіцієнти у схему:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
У лівій частині рівняння 2∙4 + 5∙3 + 3∙4 = 35 атомів Оксигену; у правій − 2∙4 + 5∙4 + 1∙4 + 3∙1 = 35.
Отже, рівняння складене правильно.
4. Підібрати коефіцієнти у схемі окисно-відновної реакції
KMnO4 + HCl (конц.) ® MnCl2 + Cl2 + KCl + H2O.
Це рівняння є прикладом міжмолекулярної окисно-відновної реакції, де відновник відіграє ще й роль солеутворювача. У кислотному середовищі
Манґан відновлюється до ступеня окиснення (+2), утворюючи манґану хлорид, а хлорид-іон кислоти окиснюється до вільного хлору. HCl – відновник, KMnO4 − окисник.
Запишемо схему електронного балансу:


 Mn+7 +5е ® Mn+2 5 2
Mn+7 +5е ® Mn+2 5 2
2Cl- - 2е ® Cl20 2 5
2KMnO4 + HCl ® 2MnCl2 + 5Cl2 + 2KCl + H2O.
Після виставлення коефіцієнтів перед атомами Хлору та Гідрогену рівняння має такий вигляд:
2KMnO4 + 16HCl (конц.) = 2MnCl2 + 5Cl2 + 2KCl + 8H2O.
У правій і лівій частинах рівняння маємо по 8 атомів Оксигену, отже, воно складене правильно.
5. Підібрати коефіцієнти в схемі окисно-відновної реакції
Cu + HNO3 (розб.) ® Cu(NO3)2 + NO + H2O.
До міжмолекулярних окисно-відновних реакцій належать також реакції взаємодії металів із кислотами.
Із металами нітратна кислота в розбавлених розчинах реагує по-різному залежно від концентрації кислоти в розчині та активності металу.
Найменш активні метали (срібло, ртуть) відновлюють нітратну кислоту лише до нітроґен (IV) оксиду, активніші (мідь, залізо) – до нітроґен (II) оксиду, ще більш активні (цинк, магній, кобальт та ін.) у більш розбавлених розчинах нітратної кислоти відновлюють її до нітроґен (І) оксиду або іонів амонію.
Із такими активними металами, як магній, цинк тощо, можуть утворюватись різні продукти відновлення (N2O, N2 чи NH4NO3), якщо зменшується кон-центрація нітратної кислоти. Чим менша її концентрація кислоти, тим нижчий ступінь відновлення нітроґену.
Зазначимо ступені окиснення всіх елементів:
0 +1 +5 –2 +2 +5 –2 +2 –2 +1 -2
Cu + HNO3 (розв.) ® Cu(NO3)2 + NO + H2O.
Ступені окиснення змінили Купрум та Нітроґен. Мідь – відновник, нітратна кислота – окисник, солеутворювач.
Складемо схему електронного балансу:








 Cu0 - 2е ® Cu+2 2 3
Cu0 - 2е ® Cu+2 2 3
N+5 + 3е ® N+2 3 2
3Cu + 8HNO3 (розв.) = 3Cu(NO3)2 + 2NO + 4H2O.
У правій і лівій частинах рівняння маємо по 24 атоми Оксигену, отже, воно складене правильно.
6. Підібрати коефіцієнти у схемі окисно-відновної реакції
Cu2S + HNO3 ® Cu(NO3)2 + H2SO4 + NO + H2O.
Дане рівняння – приклад окисно-відновної реакції, у якій кількість елементів, що змінюють ступінь окиснення, більша ніж два, тобто є два окисники або два відновники. У цьому випадку треба визначити загальне число електронів, які віддають відновники і приєднують окисники, а далі підрахувати коефіцієнти в рівнянні, як наведено в попередніх прикладах.
Позначимо ступені окиснення всіх елементів
+1 -2 +1+5–2 +2 +5 –2 +1+6–2 +2–2 +1-2
Cu2S + HNO3 ® Cu(NO3)2 + H2SO4 + NO + H2O.
Ступінь окиснення змінили Купрум, Сульфур та Нітроґен. Купрум – відновник, Сульфур – також відновник, а Нітроґен – окисник. У наведеній окисно-відновній реакції є два відновники й один окисник.
Складемо схему електронного балансу:



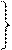 2Cu+1 - 2е ® 2Cu+2 10 3
2Cu+1 - 2е ® 2Cu+2 10 3
S-2 - 8e ® S+6 10е- 30
N+5 + 3е ® N+2 3 10
Два відновники Cu+1 і S-2 віддають 10 електронів, які приєднуються одним окисником HNO3. Основні коефіцієнти: 3 – перед Cu2S і 10 – перед NO.
3Cu2S + HNO3 ® 6Cu(NO3)2 + 3H2SO4 + 10NO + H2O.
У випадку цієї окисно-відновної реакції HNO3 − не тільки окисник,
а й солеутворювач. Після добору коефіцієнтів перед атомами Нітроґену та Гідрогену рівняння має такий вигляд:
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.
У правій і лівій частинах рівняння міститься по 66 атомів Оксигену. Отже, рівняння складене правильно.
7. Підібрати коефіцієнти у схемі окисно-відновної реакції
KСlO3 ® KCl +O2.
Для реакцій внутрішньомолекулярного окиснення−відновлення характерна зміна ступенів окиснення елементів однієї молекули, тобто окисником і відновником є елементи однієї сполуки.
Позначимо ступені окиснення всіх елементів:
+1+5 –2 +1 -1 0
KСlO3 = KCl +O2
Ступінь окиснення змінили атоми Хлору та Оксигену. Хлор – окисник. Оксиген – відновник.
Схема електронного балансу має такий вигляд:


 Cl+5 + 6е ® Cl- 6 2
Cl+5 + 6е ® Cl- 6 2
O-2 - 2 ∙ 2е ® O2 4 3
Підставимо отримані коефіцієнти в праву частину рівняння
KСlO3 ® 2KCl + 3O2
та зрівняємо кількість атомів Хлору та Оксигену в лівій і правій частинах:
2KСlO3 = 2KCl + 3O2.
В обох частинах рівняння маємо по 6 атомів Оксигену. Отже, рівняння складене правильно.
8. Підібрати коефіцієнти у схемі окисно-відновної реакції
KMnO4 ® K2MnO4 + MnO2 + O2.
Позначимо ступені окиснення всіх елементів:
+1 +7 -2 +1 +6 -2 +4 -2 0
KMnO4 ® K2MnO4 + MnO2 + O2
Ступінь окиснення змінили атоми Манґану та Оксигену, які є елементами однієї сполуки калій тетраоксоманґанату – окисника. Оксиген – відновник.


 Складемо схему електронного балансу:
Складемо схему електронного балансу:
 Mn+7 + 1е ® Mn+6 4 1
Mn+7 + 1е ® Mn+6 4 1
Mn+7 + 3e ® Mn+4 +4е- 4
O-2 - 2 ∙ 2е ® O2 4 1
Як бачимо, коефіцієнти перед окисником та відновником у правій частині дорівнюють одиниці:
KMnO4 ® K2MnO4 + MnO2 + O2.
Підрахуємо кількість атомів Манґану та Оксигену в правій частині й поставимо в лівій перед калій тетраоксоманґанатом коефіцієнт 2.
Рівняння має такий вигляд:
2KMnO4 = K2MnO4 + MnO2 + O2.
У правій і лівій частинах рівняння маємо по 8 атомів Оксигену. Отже, рівняння складене правильно.
9. Підібрати коефіцієнти у схемі окисно-відновної реакції
SnCl2 + KOH ® K2SnO3 + Sn + KCl + H2O.
У реакціях диспропорціювання один і той самий елемент являє собою
і окисник, і відновник. У таких випадках речовина з проміжним ступенем окиснення наче розкладається на дві сполуки, в одній із яких ступінь окиснення вищий, а в другій − нижчий. Позначимо ступені окиснення всіх елементів:
+2 -1 +1–2+1 +1 +4 -2 0 +1 –1 +1 -2
SnCl2 + KOH ® K2SnO3 + Sn + KCl + H2O.
Ступінь окиснення змінив Станум. Цей елемент як окисник приймє два електрони, а як відновник віддає також два електрони. Це реакція диспропорціювання.
Складемо схему електронного балансу:


 Sn+2 - 2е ® Sn+4 2 1
Sn+2 - 2е ® Sn+4 2 1
Sn+2 + 2е ® Sn0 2 1
Остаточно рівняння має такий вигляд:
2SnCl2 + 6KOH = K2SnO3 + Sn + 4KCl + 3H2O.
У правій і лівій частинах рівняння маємо по 6 атомів Оксигену, отже, воно складене правильно.
10. Підібрати коефіцієнти у схемі окисно-відновної реакції
K2SO3 ® K2SO4 + K2S.
Позначимо ступені окиснення всіх елементів:
+1+4 –2 +1+6 –2 +1 -2
K2SO3 ® K2SO4 + K2S.
Ступінь окиснення змінив Сульфур. Він є і окисник, і відновник, тобто дане рівняння – приклад реакції диспропорціювання.


 Складемо схему електронного балансу:
Складемо схему електронного балансу:
S+4 - 2е ® Sn+6 2 3
S+4 + 6е ® S-2 6 1
Рівняння має такий вигляд:
4K2SO3 = 3K2SO4 + K2S.
У правій і лівій частинах рівняння маємо по 12 атомів Оксигену, отже, воно складене правильно.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- А. Фінансові коефіцієнти
- А. Фінансові коефіцієнти
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції (реактиви)
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антиген - це полімер органічної природи, генетично чужерідний для макроорганізма, при потраплянні в який викликає імунні реакції, що направлені на його видалення.
- Антигени. Антитіла. Серологічні реакції .
- Біноміальні коефіцієнти
- Біогенні аміни та реакції декарбоксилювання
- Види опор та їх реакції
| <== попередня сторінка | | | наступна сторінка ==> |
| Задачі для самостійного розв’язування | | | Задачі для самостійного розв’язування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |