
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
І група ІІ група ІІІ група IV група V група
ААА-букви, що визначають вид документа, наприклад СОП - стандартна операційна процедура, інструктивно викладена послідовність виконання операцій.
ВВ-букви, що конкретизують призначення документа, наприклад КО - контрольні операції; ТБ - техніка безпеки персоналу.
0000- перші два знаки позначають номер підрозділу підприємства, якому належить даний документ. Таблиця коду підрозділів формується відповідно до структури підприємства. Третій і четвертий знаки резервуються для номера продукту в каталозі підприємства. У випадку, якщо даний документ має відношення до всіх або декількох продуктів підприємства, на цьому місці ставиться 00.
00- четверта група знаків, які визначають порядковий номер документа в своєму розділі, структурному підрозділі тощо;
00-п’ята група знаків визначають номер версії даного документа. Для оригіналу - номер 01.
У випадку, якщо до документа є додатки, які необхідно заповнити, то вони кодуються із врахуванням коду основного документа. Для цього з лівого боку до коду основного документа додають Ф00 (де Фозначає «форма», 00позначають порядковий номер форми серед всіх форм даного документа, що додаються).
Всі екземпляри контрольованих документів на паперових, магнітних або інших носіях, мають відповідний статус. Використання контрольованих документів без позначення статусу не допустимо - при виявленні таких документів вони підлягають вилученню і знищенню.
Для кожного документа є один контрольний екземпляр (оригінал), який зберігається у визначеному місці з обмеженим доступом і до якого в першу чергу вносяться всі зміни.
Статус документа вказується на його титульній сторінці за допомогою кольорових штампів:
· на оригіналах документів ставиться штамп червоного кольору «КОНТРОЛЬНИЙ ПРИМІРНИК» або «ОРИГІНАЛ» ;
· на копіях документа, призначених для роботи ставиться штамп зеленого кольору «ВРАХОВАНИЙ ПРИМІРНИК № _____» або «КОПІЯ №_____» ;
· на копіях документа, призначених для довідкових, навчальних і архівних цілей ставиться штамп синього кольору «НЕВРАХОВАНИЙ ПРИМІРНИК» або «ТІЛЬКИ ДЛЯ ДОВІДОК»
Для організації управління документації ведеться Реєстр типів документів, в якому вказується тип документа, рівень затвердження, відповідальність за відстежування, місце зберігання контрольних екземплярів і відповідальний за зберігання. Особа, відповідальна за зберігання оригіналів документів певного типу, веде Реєстри цих документів.
До кожного оригіналу документа додається перелік розповсюдження, в якому вказується, КОМУ і КОЛИ були передані враховані копії документа.
| Функціонування системи документації включає етапи |
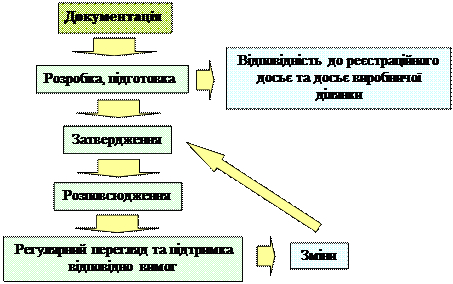 |
Дані можуть бути записані за допомогою електронної системи обробки даних, фотографічних або інших надійних засобів. При цьому потрібно мати докладні методики щодо використовуваної системи, а точність записів перевіряти. Якщо документація ведеться за допомогою електронної системи обробки даних, то тільки уповноважені на це особи можуть вводити дані в комп’ютер або змінювати їх. Зміну і видалення інформації слід протоколювати. Доступ до інформації має бути захищений паролями або іншими засобами. Результати введення критичних даних мають знаходитися під незалежним контролем. Протоколи серії, що зберігаються в електронній пам’яті, мають бути захищені шляхом створення копії на магнітному носії, мікрофільмування, розпечатування на папері або іншим способом. Дуже важливо, щоб під час зберігання інформація була легкодоступна.
Контрольні питання до теми № 13
1. Організація системи управління документацією на фармацевтичному підприємстві.
2. Структура та вимоги до управління документацією.
3. Основні принципи здійснення обігу документів на фармацевтичному підприємстві.
4. Основна документація (І рівень документації).
5. Обов’язкова реєструюча документація (IІ рівень документації): СТП і АНД.
6. Обов’язкова реєструюча документація (IІ рівень документації): реєстраційне досьє.
7. Обов’язкова реєструюча документація (IІ рівень документації): пропис.
8. Обов’язкова регламентуюча документація (III рівень документації): технологічні інструкції та інструкції з упакування.
9. Обов’язкова регламентуюча документація (III рівень документації): специфікації.
10. Обов’язкова регламентуюча документація (III рівень документації): стандартні робочі процедури і методики.
11. Первинна (робоча) документація (ІV рівень документації).
Завдання для лабораторної роботи роботи № 13
Завдання 1.Оформити відповідним чином титульний лист оригіналу та копії стандартної робочої процедури «Процедура по дотриманню особистої гігієни персоналу ділянки фасування (пакування) БАД» номер СРП-0507 (діє з 1.08.2008р., дата перегляду 1.08.2012 р.), викладеної на 6 аркушах для виробничого відділу ВАТ «ХімоФарм-Здоров’я», складеної начальником виробництва Петренко О.В., погодженої з начальником відділу управління якістю Маруновим П.І., затвердженої Генеральним директором Мацько І.І.
| Назва підприємства | СТАНДАРТНА ОПЕРАЦІЙНА ПРОЦЕДУРА | НОМЕР: | ||||
| ЛИСТ: ВСЬОГО: | ||||||
| ВІДДІЛ: | ||||||
| М.П. | ЗАТВЕРДЖЕНО: Посада ____________________П.І.Б. «__»_____________200__р. | |||||
| НАЗВА СТАНДАРТНОЇ ОПЕРАЦІЙНОЇ ПРОЦЕДУРИ | ||||||
| ДІЄ з: | ДАТА НАСТУПНОГО ПЕРЕГЛЯДУ: | |||||
| ЗАМІНЮЄ: СОП № ________ від_____________ | ПРИЧИНА ПЕРЕГЛЯДУ: | |||||
| РОЗРОБИВ: Посада _________________П.І.Б. «__»_____________200__р. ПОГОДЖЕНО: Посада _________________П.І.Б. «__»_____________200__р. | ||||||
Завдання 2.Оформити реєстраційнепосвідчення (№UA/2727/02/01, затверджене наказом МОЗ України 23.05.2006р. № 309, видане 30.05.2006р.) на лікарський засіб «Уролесан» (рідина по 25 мл у флаконах-крапельницях), зареєстрованого в Україні терміном на 5 років та підписане директором Державного фармакологічного центру МОЗ України В.Т. Чумаком. Заявник: ЗАТ «Фарм Здоров’я-плюс», Україна, 79024, м. Київ, вул. Володимирівська, 6/8. При заповненні посвідчення внести інформацію в наступні пункти: інформація про лікарський засіб (назва лікарського засобу, лікарська форма, шлях уведення, код АТС, показання до застосування, вид і розмір упаковки, термін зберігання, виробник(и) лікарського засобу), висновки про якісний та кількісний склад лікарського засобу (назва лікарського засобу, лікарська форма, якісний та кількісний склад лікарського засобу - активні речовини : 1 мл препарату містить: олії ялиці 0,0676г, олії м’яти перцевої 0,0169г, олії рицинової 0,09295г. плодів моркви дикої екстракту рідкого 0,19435г, шишок хмелю екстракту рідкого 0,2788г, трави материнки екстракту рідкого 0,19295г, допоміжні речовини - трилон Б - 0,005г).
| МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ ДЕРЖАВНИЙ ФАРМАКОЛОГІЧНИЙ ЦЕНТР м. Київ РЕЄСТРАЦІЙНЕ ПОСВІДЧЕННЯ НА ЛІКАРСЬКИЙ ЗАСІБ № Рішення про державнуреєстрацію лікарського засобу затверджене наказом МОЗ України від____________________ № _______ Згідно зі ст. 9 Закону України «Про лікарські засоби» та постановою Кабінету Міністрів України від 26.05.2005р. № 376 «Про затвердження Порядку державної реєстрації (перереєстрації) лікарських засобів і розмірів збору за їх державну реєстрацію (перереєстрацію)» лікарський засіб НАЗВА ЛІКАРСЬКОГО ЗАСОБУ, лікарська форма зареєстрований в Україні терміном на __ років Заявник: Повна назва та адреса заявника Реєстраційне посвідчення діє на всій території України до ____________________ Реєстраційне посвідчення видане ___________________________ ІНФОРМАЦІЯ ПРО ЛІКАРСЬКИЙ ЗАСІБ Назва лікарського засобу: Лікарська форма: Шлях уведення: Код АТС: Показання до застосування: Вид і розмір упаковки: Термін зберігання: Виробник(и) лікарського засобу: Повна назва та адреса(и) виробника(ів) ВИСНОВКИ ПРО ЯКІСНИЙ ТА КІЛЬКІСНИЙ СКЛАД ЛІКАРСЬКОГО ЗАСОБУ Назва лікарського засобу, лікарська форма: Якісний та кількісний склад лікарського засобу: Активні речовини: Допоміжні речовини: Посада а Державного фармакологічного центру Міністерства охорони здоров’я України ____________________ Прізвище І.Б. підпис |
Читайте також:
- I Група інвалідності
- I група катіонів
- II група катіонів
- IV група катіонів
- IV група- показники надійності підприємства
- V група катіонів
- VI група катіонів
- А група
- А група
- Види документів за ознаками класифікації та групами
- Група 3
- Група 4
| <== попередня сторінка | | | наступна сторінка ==> |
| ААА – ВВ – ОООО – ОО – ОО | | | Лабораторна робота №14. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |