
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТИПИ КРИВИХ АМПЕРОМЕТРИЧНОГО ТИТРУВАННЯ
Криві амперометричного титрування будують у координатах сили струму (і, мкА або ділінням гальванометра) – об’єм розчину доданого титранту.
Розрізняють 4 основні форми кривих титрування (рис. 2.4), що залежать від електрохімічних властивостей реагуючих компонентів.
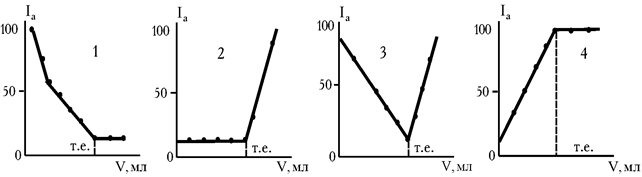
Рис. 2.4. Основні форми кривих амперометричного титрування
1. Електрохімічно активний визначуваний іон (А). На початку титрування концентрація визначуваного іона велика. Сила струму висока (рис. 2.4). Іноді вона більше 100 одиниць шкали гальванометра. При титруванні концентрація А зменшується. Сила струму стає менше:
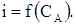
Після точки еквівалентності струм залишається постійним. Така форма спостерігається при визначенні, наприклад, заліза (II) ванадатом амонію. В аналізованому розчині проходить хімічна реакція:
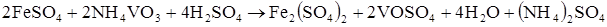
або в іонному вигляді:
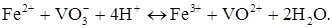
Електродна реакція. Визначуваний компонент Fe2+ окиснюється на мікроаноді. Це мікропроцес. Втрати заліза (II) практично не спостерігається
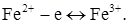
2. Електрохімічно активним при визначеній напрузі є титрант (В), надлишок якого з'являється тільки після точки еквівалентності. Тобто, поки титрант витрачається на реакцію, струм ланцюга невеликий і постійний (рис. 2.4, кр. 2), а після точки еквівалентності з появою надлишку розчину, яким титрують, фіксується збільшення струму.
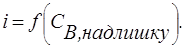
Як приклад можна розглянути титрування цинку (II) органічним реагентом 8-меркаптохіноліном (RSH).
Хімічна реакція в розчині:
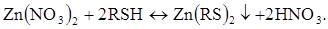
Електрохімічний мікропроцес: окислювання 8-меркаптохіноліну до дисульфіду на мікроаноді:
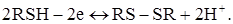
3. Якщо електрохімічно активні два компоненти А і В, тобто 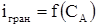 і
і 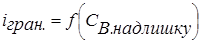 , то крива титрування виходить найбільш чіткою. Спочатку струм зменшується, а потім різко зростає (рис. 2.4, кр. 3). Розглянуту форму кривої можна одержати у випадку титрування свинцю (II) хроматом калію.
, то крива титрування виходить найбільш чіткою. Спочатку струм зменшується, а потім різко зростає (рис. 2.4, кр. 3). Розглянуту форму кривої можна одержати у випадку титрування свинцю (II) хроматом калію.
Хімічна реакція в розчині:
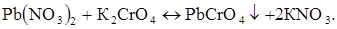
Електрохімічні реакції відновлення на мікроелектроді:
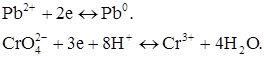
4. Електродну реакцію може давати і продукт хімічного процесу, що перебігає у розчині (речовина С). У цьому випадку в міру додавання титранту концентрація продукту реакції збільшується. Росте і струм, що фіксується мікрогальванометром.
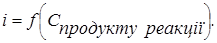
Після точки еквівалентності концентрація продукту реакції залишається постійною. Струм не змінюється (рис. 2.4, кр. 4). Прикладом такої залежності може буте амперометричне визначення миш'яку (V) йодидом калію. Титрування проводять у сильно кислому середовищі.
Хімічна реакція, яка перебігає в розчині в процесі титрування:
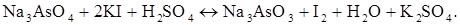
Електродний мікропроцес, що проходить на електроді:
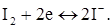
Форма кривих титрування залежить і від різниці потенціалів, що накладається на електроди. Розглянемо такий приклад. В аналізованому розчині проходить хімічна реакція, яку у загальному вигляді можна записати: А+В®С. Для вибору напруги зняті вольтамперні криві всіх речовин (рис. 2.5). Згідно з вольтамперною кривою електроактивними можуть бути визначуваний іон і титрант. Титрування проводимо при напрузі: 1) Е1; 2) Е2; 3) Е3; 4) Е4 (рис. 2.5), як змінюється струм для цих чотирьох випадків?
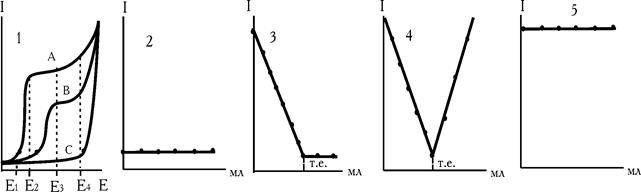
Рис. 2.5. Форма кривих титрування в залежності від напруги, що накладається на електроди
При напрузі Е1 потенціал виділення А і В не досягається. Хімічна реакція в розчині проходить, а електродна – ні, в зв'язку з чим струм не змінюється. Точку еквівалентності ми не бачимо (рис. 2.5, кр.2). Напруга обрана не вірно.
При напрузі Е2 електродну реакцію дає визначуваний іон. При цій напрузі починається і його площадка дифузійного граничного струму. Тому крива титрування «ель-подібна»: L (рис. 2.5, кр. 3).
Напруга, що накладається, Е3 відповідає площадкам граничного струму двох компонентів А і В. У зв'язку з цим після точки еквівалентності спостерігається ріст 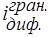 (рис. 2.5, кр. 4).
(рис. 2.5, кр. 4).
І нарешті, напруга Е4 занадто висока. При цій напрузі високий струм окиснювання фону, не дозволяє фіксувати зміни iгран., викликане електродними реакціями речовин А і В. Напруга, як і в першому випадку обрана невірно.
Тому що на мікроелектродах у залежності від їх поляризації і природи компонентів можуть проходити електроокиснення або електровідновлення компонентів, то на осі ординат іноді уточнюють, який виникає струм, анодний або катодний.
Не рідко для вольтамперних кривих знімають цілком анодно-катодні хвилі (рис. 2.6). Наприклад, для 8-меркаптохіноліну, C9H6NSNa, така крива має вигляд наданий на рис. 6. 8-меркаптохінолін окиснюється на мікроаноді. Площадка граничного дифузійного струму знаходиться в межах +0,8–1,0 В. При більш високому потенціалі починається окиснювання фону. А при Е менше +0,2 відновлюється розчинений у воді кисень:

а потім (точка Д) – іони водню
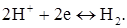
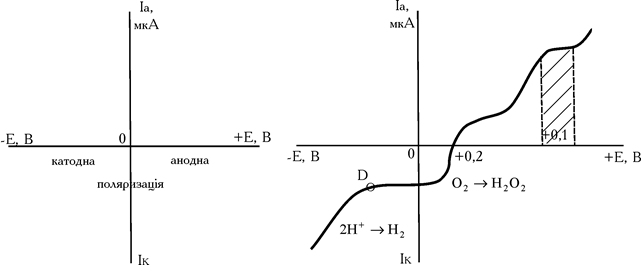
Рис. 2.6. Форма анодно-катодних вольтамперних кривих
У результаті чого виникає катодний струм відновлення цих іонів. Напрямок струму змінюється. На гальванометрі переключають контрольні клеми. Чим більше напруга, тим більше сила струму в ланцюзі.
Для окиснювально-відновного амперометричного титрування заліза (II) церієм, у розчині перебігає хімічна реакція:

яку в іонному вигляді можна записати:
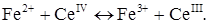
Визначуваний іон Fe2+ може окиснюватися на мікро електроді, а титрант СеIV відновлюється (рис. 2.7, кр.1,2). Якщо титрування проводити при напрузі Е1, можливий тільки один електродний процес – відновлення церію (IV) на електроді і крива титрування має форму наведену на рис. 2.7,кр.3. Зміна струму фіксується з появою надлишку церію (IV). При напрузі Е2 – відповідним двом площадкам дифузійного струму, визначуваний компонент, Fe2+, може окиснюватися на мікроелектроді. Концентрація заліза в міру титрування зменшується, зменшується і дифузійний анодний струм (рис. 2.7, кр.4). Після точки еквівалентності з'явиться надлишок церію (IV). Останній в умовах проведення експерименту відновлюється і катодний струм теж збільшується (рис. 2.7, кр.4).
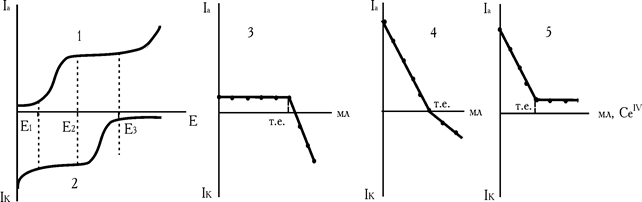
Рис. 2.7. Вольтамперні криві Fe2+ (1) і CeIV (2). Криві амперометричного титрування заліза (II) при напрузі Е1 (3), Е2 (4) і Е3 (5)
Нарешті, при напрузі Е3 електроактивним є тільки залізо (II) (рис. 2.7, кр. 5).
У випадку, якщо хімічна реакція носить більш складний характер: ступінчате комплексоутворення або окиснення-відновлення, і продукти реакції електрохімічно активні, криві титрування можуть мати «аномальну» форму.
8-меркаптохінолін, наприклад, утворює в ацетатно-буферних розчинах із ртуттю (II), міддю (II) індієм (III) проміжні розчинні комплекси, [MeAcRS]–m, що окиснюються на електроді. У процесі титрування ці комплекси диспропорціонують і перетворюються в малорозчинні внутрішньокомплексні сполуки. Тому на початку титрування струм росте, а потім, при утворенні ВКС, зменшується. Після точки еквівалентності з'являється надлишок титранту і струм знову збільшується (рис. 2.8, кр.1). Крива титрування має форму симетричного або несиметричного «дзвону».
Аналогічні ефекти спостерігаються і при титруванні на фоні хлористого калію свинцю (II) диетілдитіокабамінатом натрію і вісмуту (III) гексаметілендитіокарбамінатом Na (рис. 2.8, кр.2).
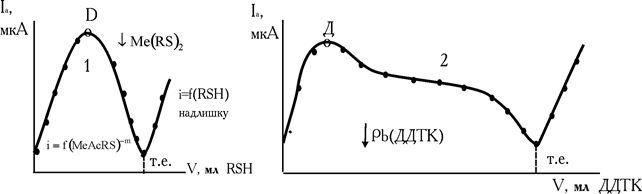
Рис. 2.8. Криві амперометричного титрування Cu2+ 8-меркаптохіноліном (1) і Pb2+(2) розчином діетилдитіокарбамінату
Проміжний розчинний комплекс, [PbOHДДTK]–, окиснюється на мікроелектроді. У визначений момент (точка Д) починається диспропорціонування. Утворюється малорозчинний продукт Pb(ДДTK)2. Концентрація комплексу зменшується, iгран. теж стає менше.
У курсі кількісного аналізу, хімічні методи, у розділі “Перманганатометрія” розглядалося питання автокаталізу та індукованих процесів. Показано, що взаємодія щавлевої кислоти з перманганатом проходить через ряд проміжних реакцій, у яких бере участь продукт реакції Mn2+. Він прискорює проміжні стадії і в остаточному підсумку регенерується і виділяється в такій же кількості. Схеми процесів схематично зображені таким чином:
|
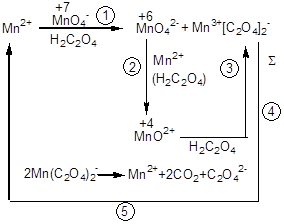
Утворення марганцю різного ступеня окиснювання як проміжного продукту наочно фіксується при амперометричних титруваннях KMnО4 щавлевою кислотою і розчинами сірковмісних реагентів (рис. 2.9, кр.1, 2).
Надлишок щавлевої кислоти при напрузі, що накладається, не дає електродної реакції. Підйому в точці «Д» немає. У випадку 8-меркаптохіноліна Mn3+ реагує з RSH, і утворюють тіооксинат марганцю. З появою надлишку титранту струм зростає.
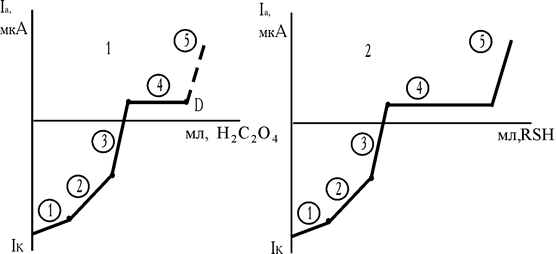
Рис. 2.9. Криві амперометричного титрування KMnО4 щавлевою кислотою (1) і
8-меркаптохіноліном (2)
Читайте також:
- Амперометричне титрування
- АМПЕРОМЕТРИЧНЕ ТИТРУВАННЯ З ДВОМА ІНДИКАТОРНИМИ ЕЛЕКТРОДАМИ
- Броматометрія, зворотне титрування, з йодометричним закінченням
- Вибір індикатора . Криві титрування
- Визначення кінця титрування
- Визначення, утворення та класифікація кривих ліній
- Загальна характеристика формоутворення кривих ліній та кривих поверхонь
- Задачі інцидентності на кривих поверхнях
- Кислотно – основне титрування
- Кислотно-основне титрування в неводних середовищах
- Коефіцієнти, що характеризують форму несинусоїдних періодичних кривих
- Криві титрування
| <== попередня сторінка | | | наступна сторінка ==> |
| Органічні сполуки, які визначають амперометричним титруванням | | | ХАРАКТЕРИСТИКА РЕАГЕНТІВ, ЩО ВИКОРИСТОВУЮТЬ В ЯКОСТІ ТИТРАНТІВ В АМПЕРОМЕТРІЇ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |