
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічна рівновага
Оборотні реакції не доходять до кінця і завершуються встановленням хімічної рівноваги. Наприклад, у реакції синтезу амоніаку рівновага настає тоді, коли за одиницю часу утворюється стільки ж молекул амоніаку, скільки їх розпадається на азот і водень. Отже,
хімічну рівновагу можна визначити як такий стан системи реагуючих речовин, при якому швидкості прямої і зворотної реакцій дорівнюють одна одній.
У стані рівноваги пряма і зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною, рівновагою. А оскільки дія обох реакцій взаємно знишується, то в реагуючій суміші видимих змін не відбувається: концентрації всіх реагуючих речовин – як вихідних, так і тих, що утворюються, – залишаються чітко сталими.
Кількісною характеристикою хімічної рівноваги є її константа. Розглянемо це на прикладі взаємодії оксиду сульфуру(ІV) з киснем:
2SО2 + О2 ↔ 2SО3.
Швидкість прямої реакції, згідно з законом дії мас, дорівнює:
v1 = К1 [SО2]2 [О2],
швидкість зворотної реакції
v2 = К2 [SО3]2.
В момент встановлення хімічної рівноваги v1 = v2, тобто
К1 [SО2]2 [О2] = К2 [SО3]2,
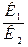 =
= 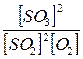 .
.
Відношення К1/К2 є також сталою величиною, тому останнє рівняння можна записати так:
К = 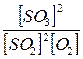 .
.
Отже, в момент встановлення хімічної рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин є сталою величиною. Ця величина називається константою хімічної рівноваги.
Рівноважні концентрації – це концентрації, що встановлюються в стані хімічної рівноваги.
Константа хімічної рівноваги показує, що за умови рівноваги концентрації всіх речовин пов'язані між собою: в разі зміни концентрації будь-якої з реагуючих речовин змінюються концентрації всіх інших речовин. У результаті встановлюються новий стан рівноваги і нові концентрації, але співвідношення між ними залишаються незмінними, вони відповідають константі рівноваги.
Для гетерогенних реакцій у вираз константи рівноваги, аналогічно виразу закону дії мас, входять концентрації тільки тих речовин, які перебувають у газовій або рідкій фазі. Тому для реакції
СО2 + С ↔ 2СО
вираз константи хімічної рівноваги запишеться так:
К = [СО]2 /[СО2].
Константа хімічної рівноваги визначає глибину перебігу процесу в момент досягнення стану рівноваги. Чим більша величина К, тим повніше взаємодіють речовини. Повнота перебігу процесу залежить від концентрації реагентів. Знаючи величину К, можна обчислити теоретично можливий вихід продуктів реакції. Величина константи хімічної рівноваги залежить від природи реагуючих речовин, температури і не залежить від тиску (в разі не дуже високого його значення), концентрації реагуючих речовин і продуктів реакції та від наявності або відсутності домішок.
Читайте також:
- Баланс сил і рівновага в МС
- Біохімічна гіпотеза виникнення життя.
- Біохімічна ОБГРУНТУВАННЯ МЕТОДИКИ занять фізичною культурою і спортом з особами різного віку та статі
- Біохімічна характеристика тренованого організму
- Взаємодія попиту і пропозиції та ринкова рівновага.
- Взаємодія попиту і пропозиції. Ринкова рівновага.
- Взаємодія попиту й пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції: ринкова рівновага.
- Взаємозв'язок сукупного попиту та сукупної пропозиції. Макроекономічна рівновага
- Вибір фірмою обсягу виробництва і рівновага конкурентного ринку у довгостроковій перспективі
- Гази крові, та кислотно-лугова рівновага.
| <== попередня сторінка | | | наступна сторінка ==> |
| Необоротні й оборотні реакції | | | Принцип Ле Шательє |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |