
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Дисоціація води. Водневий показник
Ступінь дисоціації — це відношення кількості молекул електроліту, що розпалися на йони (n), до загальної кількості розчинених молекул (N).
α = (кількість молекул речовини, що розпалися на йони) / (загальна кількість молекул речовини) або α = n / N.
Ступінь дисоціації електроліту виражається в частках одиниці або у відсотках. Якщо α → 0% (або до 0), дисоціація практично відсутня, а якщо α → 100% (або до 1), то практично всі молекули електроліту розпадаються на йони. Якщо α = 74%, то це показує, що зі 100 молекул даного електроліту 74 розпалися на йони, а 100 – 74 = 26 молекул не розпалися.
Різні електроліти мають різний ступінь дисоціації. Ступінь дисоціації залежить від концентрації розчину і температури. При розведенні розчину і підвищенні температури ступінь дисоціації збільшується, оскільки дисоціація електроліту проходить більш повно. За ступенем дисоціації електроліти поділяють на сильні, середні і слабкі. Якщо α більше 30%, такі електроліти називають сильними. Сильні електроліти при розчиненні у воді повністю дисоціюють на йони. До сильних електролітів належать: більшість солей, багато мінеральних кислот (Н2SO4, НNО3, НСl), луги. Якщо α менше 30%, але більше 3%, такі електроліти називаються середніми. Середні електроліти при розчиненні у воді не повністю дисоціюють на йони. До середніх електролітів належать деякі мінеральні кислоти (Н3РО4, НF). Якщо α менше 3%, такі електроліти називаються слабкими. Слабкі електроліти при розчиненні у воді лише частково дисоціюють на йони. До слабких електролітів належить більшість органічних кислот, деякі мінеральні кислоти (НСlO, НСN), ряд основ, у т.ч. NH4ОН. Вода також є слабким електролітом.
Вода як слабкий електроліт незначною мірою дисоціює на йони Н+ і ОНֿ, що перебувають у рівновазі з недисоційованими молекулами:
Н2О ↔ Н+ + ОНֿ.
Концентрацію йонів звичайно виражають у молях йонів в 1 л. Як видно з рівняння дисоціації води, у ній величини [Н+] і [ОНֿ] однакові. Експериментально встановлено, що в одному літрі води при кімнатній температурі (22º С) дисоціації піддається лише 10-7 мольводи і при цьому утворюється 10-7 моль/лйонів Н+ і 10-7 моль/л йонів ОНֿ.
Добуток концентрації йонів Гідрогену і гідроксид-іонів у воді називається йонним добутком води (позначається КВ). При певній температурі КВ – величина стала, чисельно дорівнює при 22º С 10-14:
КВ = [Н+] [ОНֿ] = 10-7 · 10-7 = 10-14.
Сталість добутку [Н+] [ОНֿ] означає, що в будь-якому водному розчині ні концентрація йонів Гідрогену, ні концентрація гідроксид-іонів не може дорівнювати нулю. Іншими словами, будь-який водний розчин кислоти, основи або солі містить як Н+, так і ОНֿ – іони. Дійсно, для чистої води [Н+] = [ОНֿ] = 10-7 моль/л. Якщо у воду добавити кислоту, то [Н+] стане більшою, ніж 10-7, а [ОНֿ] – меншою, ніж 10-7 моль/л. І навпаки, якщо у воду добавити луг, то [Н+] стане меншою, ніж 10-7, а [ОНֿ] – більшою, ніж 10-7 моль/л.
Із сталості добутку [Н+] [ОНֿ] випливає, що при збільшенні концентрації одного з йонів води відповідно зменшується концентрація іншого йона. Це дозволяє обчислити концентрацію Н+– іонів, якщо відома концентрація ОНֿ– іонів, і навпаки. Наприклад, якщо у водному розчині [Н+] = 10-3 моль/л, то [ОНֿ] визначатиметься так:
[ОНֿ] = КВ / [Н+] = 10-14 / 10-3 = 10-11 моль/л.
Отже, кислотність і основність розчину можна виражати через концентрацію або йонів Н+, або йонів ОНֿ. На практиці користуються першим способом. Тоді для нейтрального розчину [Н+] = 10-7, для кислого [Н+] > 10-7, для лужного [Н+] < 10-7 моль/л.
Щоб уникнути незручностей, зв’язаних із застосуванням чисел з від’ємними показниками ступеня, концентрацію йонів Гідрогену прийнято виражати через водневий показник, що позначається символом рН (читається «пе-аш»).
Водневим показником рН називається десятковий логарифм концентрації йонів Гідрогену, взятий з протилежним знаком:
рН = – lg [Н+]
або
[Н+] = 10– рН,
де [Н+] – концентрація йонів Гідрогену, моль/л.
Поняття «водневий показник» було введене датським хіміком Серенсеном у 1909 р.: буква «р» – початкова буква датського слова роtеnz – математичний ступінь, буква «Н» – символ Гідрогену.
За допомогою рН реакція розчинів характеризується так: нейтральна – рН = 7, кисла – рН < 7, лужна – рН > 7. Наочно реакцію розчинів можна виразити схематично у вигляді шкали рН.
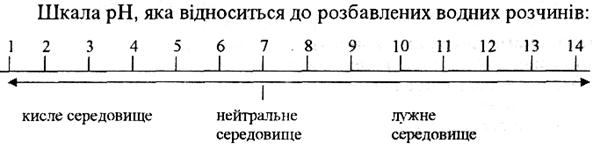
З усього цього можна зробити висновок, що, чим менший рН, тим більша концентрація йонів Н+, тобто вища кислотність середовища; і навпаки, чим більший рН, тим менша концентрація йонів Н+, тобто вища основність середовища.
Наведемо значення рН деяких найбільш відомих розчинів і зазначимо відповідну їм реакцію середовища: шлунковий сік – рН = 1,7 (сильнокисла реакція), торф’яна вода – рН = 4 (слабкокисла), дощова вода – рН = 6 (слабкокисла), водопровідна вода – рН = 7,5 (слабколужна), кров – рН = 7,4 (слабколужна), слина – рН = 6,9 (слабкокисла), сльози – рН = 7 (нейтральна).
Винятково велика роль рН у найрізноманітніших явищах і процесах – і в природі, і в техніці. Багато виробничих процесів у хімічній, харчовій, текстильній та інших галузях промисловості відбуваються лише при певній реакції середовища.
Приблизне визначення рН у водних розчинах проводять за допомогою хімічних індикаторів, які змінюють свій колір у певному інтервалі значень рН.
Читайте також:
- IV група- показники надійності підприємства
- Абсолютні показники фінансової стійкості
- Абсолютні показники фінансової стійкості та її типи
- Абсолютні та відності показники результатів діяльності підприємства.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Аналіз відносних показників прибутковості (рентабельності) роботи банку
- Аналіз макроекономічних показників
- Аналіз основних техніко-економічних показників діяльності підприємств будіндустрії
- Аналіз показників валового прибутку і собівартості реалізованої продукції
- Аналіз показників прибутковості та рентабельності підприємства
- Аналіз показників рентабельності.
- Аналіз показників складу, структури й технічного стану основних фондів.
| <== попередня сторінка | | | наступна сторінка ==> |
| Електролітична дисоціація (йонізація) — це розпад електролітів на сольватовані (гідратовані) йони під дією молекул розчинника. | | | Гідроліз солей |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |