
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Складання рівнянь окисно-відновних реакцій
Класифікація окисно-відновних реакцій
Окисно-відновні реакції (ОВР) поділяють на три типи:
1. Міжмолекулярні ОВР — це реакції, у яких окисник і відновник перебувають у різних речовинах.
П р и к л а д. У реакції Сu + Нg(NO3)2 = Сu(NO3)2 + Нg проста речовина мідь є відновником, а складна речовина меркурій нітрат Нg(NO3)2 — окисником. Мідь і меркурій нітрат — різні речовини.
2. Внутрішньомолекулярні ОВР — це реакції, у яких окисник і відновник перебувають у тій самій речовині.
П р и к л а д. У реакції 2КСlO3 = 2КСl + 3O2 атоми Сl+5 є окисниками, йони О2ˉ відновниками. Атоми Сl+5 і О2ˉ входять до складу однієї речовини КСlO3.
3. ОВР диспропорціювання — це реакції, у яких окисником і відновником є атоми того самого елемента.
П р и к л а д. У реакції 3HNO3 = НNO2 + Н2O вихідна речовина — нітритна кислота НNO2 — містить атом Нітрогену з проміжним ступенем окиснення +3. У результаті реакції утворюються складні речовини, одна з яких містить атоми Нітрогену з більш високим ступенем окиснення (+5) — нітратна кислота, а інша з більш низьким ступенем окиснення (+2) — нітроген оксид. Атом Нітрогену зі ступенем окиснення +3 одночасно є і відновником, і окисником.
При складанні рівнянь ОВР застосовуються два методи — метод електронного балансу і метод йонно-електронний (метод напівреакцій).
За допомогою методу електронного балансу розрахунок кількостей прийнятих і відданих електронів здійснюється відповідно до значень ступенів окиснення атомів до і після реакції. Послідовність дій при цьому методі така:
1. Скласти схему реакції із зазначенням вихідних речовин і продуктів реакції.
2. Визначити ступінь окиснення атомів у речовинах правої і лівої частин схеми; зазначити атоми, ступінь окиснення яких змінюється.
3. Скласти рівняння процесів окиснення і відновлення; знайти баланс кількості електронів, відданих при окисненні і прийнятих при відновленні, шляхом уведення множників, що визначають з найменшого кратного для коефіцієнтів у процесах окиснення і відновлення.
4. Розставити отримані окисно-відновні коефіцієнти в схемі реакції.
5. Розставити відсутні коефіцієнти перед формулами всіх речовин у лівій і правій частинах рівняння і перевірити матеріальний баланс рівняння.
П р и к л а д. Складання рівняння окисно-відновної реакції магнію з розведеною нітратною кислотою.
1. Записуємо схему реакції:
Мg + НNO3 → Мg(NO3)2 + N2O + Н2O.
2. Знаходимо окисник і відновник:
0 +5 -2 +1
Мg + НNO3 → Мg(NO3)2 + N2O + Н2O.
Мg — відновник, НNO3 — окисник.
3. Складаємо рівняння електронного балансу:

 Відновник Мgº – 2еˉ = Мg+2 4 – окиснення
Відновник Мgº – 2еˉ = Мg+2 4 – окиснення
Окисник 2N+5 + 8еˉ = 2N+1 1 – відновлення
Для напівреакції окиснення коефіцієнтом є чотири, а для напівреакції відновлення — одиниця.
4Мg + 2N+5 → 4Мg+2 + 2N+1.
4. Розставляємо отримані коефіцієнти в схемі реакції:
4Мg + НNO3 → 4Мg(NO3)2 + N2O + Н2O.
5. Складаємо рівняння реакції:
4Мg + 10НNO3 → 4Мg(NO3)2 + N2O + 5Н2O.
Метод йонно-електронний (метод напівреакцій). Цей метод грунтується на складанні йонних рівнянь для процесу окиснення і відновлення з наступним підсумовуванням їх у загальне рівняння. Послідовність дій при цьому методі така:
1. Визначити ступінь окиснення атомів у схемі реакції.
2. Скласти йонну схему реакції.
3. Записати йонні рівняння напівреакцій окиснення і відновлення, зрівняти в лівій і правій частинах рівнянь кількість атомів кожного елемента, додаючи для балансу відповідні речовини і продукти дисоціації молекул води.
4. Підсумувати рівняння обох напівреакцій з урахуванням електронного балансу.
5. Записати рівняння реакції, використовуючи коефіцієнти електронного балансу.
П р и к л а д. Рівняння окисно-відновної реакції між натрій сульфітом Nа2SO3 і калій перманганатом КМnO4 у кислому середовищі Н2SO4 складаємо в такий спосіб:
1. Визначаємо ступінь окиснення атомів у схемі реакції:
+4 +7 +6 +2
Nа2SO3 + КМnO4 + Н2SO4 → Na2SO4 + МnSO4 + К2SO4 + Н2O.
2. Складаємо йонну схему реакції:
SO32ˉ + МnO4ˉ + Н+ → SO42ˉ + Мn2+.
3. Записуємо рівняння напівреакцій окиснення й відновлення і вирівнюємо число атомів кожного елемента, додаючи для балансу атомів відповідні речовини.

 SO32ˉ – 2еˉ + Н2О = SO42ˉ + 2Н+ 5 – окиснення
SO32ˉ – 2еˉ + Н2О = SO42ˉ + 2Н+ 5 – окиснення
МnО4ˉ + 5еˉ + 8Н+ = Мn2+ + 4Н2O 2 – відновлення
Рівняння напівреакції окиснення має такий йонно-електронний вигляд:
5SO32ˉ – 10еˉ + 5Н2O = 5SO42ˉ + 10Н+
Рівняння напівреакції відновлення має такий йонно-електронний вигляд:
2МnО4ˉ+ 10еˉ + 16Н+ = 2Мn2+ + 8Н2O.
4. Підсумовуємо рівняння обох напівреакцій:
5SO32ˉ – 10еˉ + 5Н2О = 5SO42ˉ + 10Н+
2МnО4ˉ + 10еˉ + 16Н+ = 2Мn2+ + 8Н2O
_______________________________________________________________________
5SO32ˉ + 2МnО4ˉ + 6Н+ = 5SO42ˉ + 2Мn2+ + 3Н2O
5. Записуємо рівняння реакції:
5Nа2SO3 + 2КМnO4 + 3Н2SO4 → 5Na2SO4 + 2МnSO4 + К2SO4 + 3Н2O.
Складання рівнянь окисно-відновних реакцій за допомогою методу напівреакцій приводить до того самого результату, що і метод електронного балансу. Перевага методу напівреакцій порівняно з методом електронного балансу в тому, що в ньому застосовуються не гіпотетичні, а реально існуючі йони. У розчині немає йонів Мn+7, Сг+6, S+6, а є йони МnO4ˉ, СгО42ˉ, Сr2O72ˉ, SO42ˉ. При цьому методі виявляється роль середовища як активного учасника всього процесу. При використанні методу напів реакцій не треба знати всі продукти реакції, вони з’являються в рівнянні реакції при виведенні його. Однак метод електронного балансу менш трудомісткий, і він часто використовується для визначення коефіцієнтів хімічного рівняння, коли всі учасники реакції визначені.
Окисно-відновні реакції — найрозповсюдженіші в природі і техніці. Вони є основою життєдіяльності: фотосинтезу, дихання, обміну речовин. їх можна спостерігати при згорянні палива, при електролізі, у процесах корозії металів. Окисно-відновні реакції є основою металургійних процесів. З їхньою допомогою одержують багато яких хімічних речовин. Завдяки цим реакціям відбувається перетворення хімічної енергії на електричну в гальванічних елементах і акумуляторах.
 Запитання і завдання для контролю і самоконтролю знань
Запитання і завдання для контролю і самоконтролю знань
1. Які реакції називаються окисно-відновними?
2. Розкрийте умови і характер перебігу окисно-відновного процесу.
3. Як залежить перебіг окисно-відновного процесу від реакції середовища? Наведіть приклади.
4. Перелічіть типи окисно-відновних реакцій.
5. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками? Назвіть найголовніші відновники й окисники.
6. Розкрийте роль окисно-відновних реакції в природі і техніці.
7. Визначте ступінь окиснення Сr в таких сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3.
8. Вкажіть, які з приведених процесів являють собою окиснення, а які – відновлення: S → SO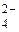 ; S → S
; S → S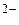 ; Sn → Sn
; Sn → Sn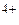 ; К → К+; Вr2 → 2Вr
; К → К+; Вr2 → 2Вr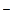 ; 2Н+ → Н2; Н2 → 2Нˉ; Сlˉ→ СlО
; 2Н+ → Н2; Н2 → 2Нˉ; Сlˉ→ СlО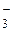 ; V2+ → VO3ˉ; IО
; V2+ → VO3ˉ; IО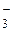 → I2 ; МnО
→ I2 ; МnО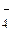 → МnО
→ МnО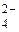 .
.
Лекція4.4. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
План
Читайте також:
- II. Вимоги до складання паспорта бюджетної програми
- Аналогія величин і рівнянь поступального і обертального руху. Кінетична енергія обертання тіла
- Бюджетні запити: їх суть, необхідність складання та аналіз
- ВИБІР ТЕМИ КУРСОВОЇ РОБОТИ І СКЛАДАННЯ ПЛАНУ
- Вибір типу обмотки і складання схеми.
- Вибір типу обмотки і складання схеми.
- Виділення мікротем у власному висловлюванні. Складання плану
- Визначення коефіцієнтів рівнянь лінійної регресії для багатофакторної задачі
- Визначення опорних реакцій трьохшарнірної арки
- Визначення реакцій балки
- Визначення реакцій в’язей
- Визначення термінів та мета складання Звіту про рух грошових коштів
| <== попередня сторінка | | | наступна сторінка ==> |
| Найголовніші окисники і відновники | | | Гальванічний елемент |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |