
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Гальванічний елемент
Корозія та захист металів
Електроліз
Ряд електрохімічних потенціалів металів
Електродні потенціали
Гальванічний елемент
 Література
Література
/1/ - Романова Н. В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 10. § 10.2-10.4).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с.
(Глава ІХ. § 98-103).
Характерною властивістю металів є їх здатність лише віддавати електрони. тобто вільні метали можуть виступати тільки в ролі відновників.
Здатність металів до утворення вільних позитивно заряджених йонів яскраво виявляється в реакціях витіснення металів з їхніх солей іншими, активнішими металами або під час взаємодії з кислотами-неокисниками. Наприклад, під час взаємодії цинку з хлоридною або розбавленою сульфатною кислотою відбувається окисно-відновна реакція витіснення Гідрогену цинком.
Здатність різних металів віддавати електрони оцінюють за реакціями витіснення цих металів з їхніх солей іншими металами. Так, якщо цинкову пластинку занурити в розчин купрум сульфату, то відбудеться окисно-відновна реакція
Zn + Сu2+ = Сu↓ + Zn2+.
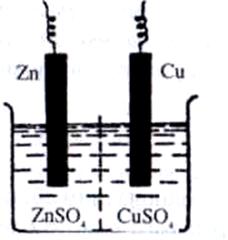
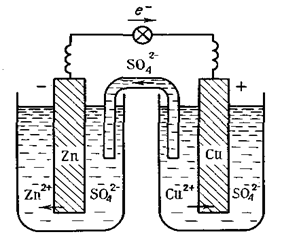
Рис. 5.Схема мідно-цинкового гальванічного елемента
Ця реакція відбувається, наприклад, у гальванічному елементі, в якому цинкова пластинка (один електрод) занурена у розчин цинк сульфату, а мідна (другий електрод) — у розчин купрум(ІІ) сульфату. Сполучивши цинковий та мідний електроди з гальванометром і з’єднавши розчини U-подібною трубкою, заповненою розчином електроліту КNO3, дістають гальванічний елемент (елемент Якобі-Даніеля, рис. 5).
Після встановлення у гальванічному колі контакту стрілка гальванометра відхиляється у напрямку до мідного електрода. Це свідчить про те, що під час роботи гальванічного елемента електрони рухаються від цинкового електрода до мідного.
Гальванічний елемент — це прилад, що служить для перетворення хімічної енергії окисно-відновної реакції на електричну. У гальванічному елементі електрони переходять від відновника до окисника не безпосередньо, а по провіднику електричного струму — по зовнішньому колу. Цей напрямлений потік електронів і є електричним струмом.
На цинковому електроді елемента Якобі-Даніеля відбувається розчинення цинку з перетворенням його атомів на йони, тобто процес окиснення:
Znº – 2еˉ = Zn2+,
а вивільнені електрони по провіднику переходять на мідний електрод, де відбувається розряджання катіонів Купруму (процес відновлення), що супроводжується виділенням металічної міді:
Сu2+ + 2еˉ = Сuº↓.
Сумарне рівняння реакції, внаслідок якої у колі виникає електричний струм, матиме вигляд:
Znº + Сu2+ = Zn2+ + Сuº↓,
або в молекулярній формі:
Zn + CuSO4 = Cu + ZnSO4.
Схематично гальванічний елемент Якобі-Даніеля зображують так:
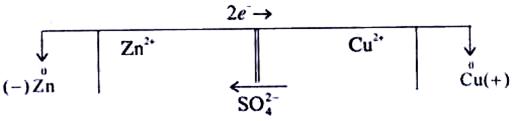
,
або (–) Zn| ZnSO4 || CuSO4| Cu (+).
Із схеми видно, що в розчині катіони Zn2+ і Сu2+ переміщуються від цинкового електрода до мідного, а аніони SO42ˉ — у зворотному напрямку. Електрод, на якому відбувається процес окиснення, називається анодом, а електрод, на якому відбувається процес відновлення, — катодом. У мідно-цинковому елементі анодом є цинковий електрод, а катодом — мідний.
Електричний струм, що проходить по зовнішньому колу гальванічного елемента, здатний виконувати певну корисну роботу. Величина роботи, яку можна виконати внаслідок перетворення хімічної енергії окисно-відновної реакції, що відбувається в гальванічному елементі, залежить від величини струму, який виникає в цьому елементі.
Електрорушійною силою гальванічного елемента Е° називається максимальне значення напруги гальванічного елемента, що відповідає перебігу реакції в прямому і зворотному напрямках. Електрорушійна сила гальванічного елемента дорівнює різниці потенціалів між його електродами.
Величину Е° можна обчислити за різницею стандартних електродних (окисно-відновних) потенціалів φ°. Так, для реакції, що відбувається в елементі Якобі—Даніеля,
Е° = φ°Cu – φ°Zn.
Для обчислення Е від величини потенціалу катода слід відняти величину потенціалу анода. В гальванічному елементі, як уже зазначалось, катодом є позитивно заряджений електрод, анодом — негативно заряджений (під час електролізу — навпаки).
Якщо стандартна е. р. с. гальванічного елемента Е° має додатну величину (ΔGº < 0), то це означає, що дана реакція йде в прямому напрямку, а якщо від’ємну — у зворотному.
Поляризація – це зміна величини електродного потенціалу катода чи анода через зміну стану поверхні електрода – утворення нерозчинних солей, оксидних і газових плівок, які виникають на поверхні електрода при роботі гальванічного елемента.
Н а п р и к л а д, для гальванічного елемента:
Zn|H2SO4|Cu на катоді відбувається процес: 2H+ + 2еˉ → H2↑.
Хімічна поляризація в цьому випадку обумовлена утворенням газової плівки водню, що ізолює поверхню катода від розчину електроліту, в наслідок чого зменшується е. р. с.
Концентраційна поляризація електродіввиникає за рахунок зміни концентрації йонів у приповерхневому шарі електрода, що впливає на величину потенціалу електрода.
Н а п р и к л а д, при роботі мідно-цинкового гальванічного елемента:
Zn| ZnSO4 || CuSO4| Cu зростає концентрація йонівZn2+ біля анода і зменшується концентрація йонів Сu2+ біля катода, це призводить до зближення потенціалів катода і анода, тобто до зменшення е. р. с.
Усунення або зниження поляризації називається деполяризацією. Концентраційна поляризація зменшується за рахунок перемішуванням електроліту, а хімічна – введенням деполяризаторів.
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- Адвокатура — неодмінний складовий елемент механізму забезпечення прав людини.
- Адміністративне правопорушення як підстава юридичної відповідальності: ознаки і елементи.
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- Аналіз витрат на підприємстві за їх елементами та статтями калькуляції.
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
- БАГАТОПОЛЮСНИМИ ЕЛЕМЕНТАМИ
- Базові елементи управління проектом
- Будова атомів хімічних елементів.
- Будова й основні елементи машини
- Будова нагрівальних елементів
- Будова систем: підсистема, елемент, структура, зв'язок.
| <== попередня сторінка | | | наступна сторінка ==> |
| Складання рівнянь окисно-відновних реакцій | | | Електродні потенціали |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |