
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакція нітрування (нітрації).
Введення нітрогрупи в молекулу органічної речовини за допомогою наступних основних способів:
– заміщення атому водню на нітрогрупу:
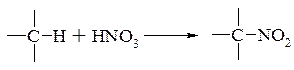
- з фторбензену – динітрофторбензен

- нітрування аліфатичних, аліциклічних і жирноароматичних сполук розбавленою азотною кислотою (12-20%) називають реакцією Коновалова
- парофазне нітрування алканів азотною кислотою (60-70%) називають реакцією Хасса
- нітрування ароматичних сполук при дії суміші неорганічних нітратів (наприклад, міді (II) і заліза (III)) і оцтового ангідриду в льодяній оцтовій кислоті називають реакцією Менке.
– заміщення групи або атому (галогену, CH3CO, SiR3, N2 і інші) на нітрогрупу
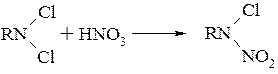
- нітрування α-галогеннітроалканів в гем-динітроалкани при дії нітриту калію в лужному середовищі називають реакцією Тер-Меєра

- реакція отримання аліфатичних нітросполук із алкілгалогенідів і нітриту срібла (реакція Мейєра) на холоді в ефірі
– приєднання по кратному вуглець-вуглецевому зв’язку з утворенням нітросполук (або динітросполук)

3.1. Нітрування парафінів.
Як і при реакції сульфування, нітрування парафінів і циклопарафінів в умовах, які сприятливі для електропрофільного заміщення, не приводить до позитивних результатів. Тільки при високих температурах, які сприяють утворенню вільних радикалів і атомів, вдається здійснити нітрування по насиченому атому вуглецю. В промисловості для нітрування парафінів використовують наступні умови:
– в газовій фазі при 350-500°С 40-70%-ною азотною кислотою
– в рідкій фазі при 100-200°С 50-70%-ною азотною кислотою
– в рідкій або газовій фазі чотирьохокисом азоту N2O4
3.2. Нітрування олефінів.
Пряме нітрування олефінів азотною кислотою рідко приводить до позитивних результатів по причині сильного розвитку побічних процесів окислення по подвійному зв’язку з утворенням складної суміші продуктів. Нітрування олефінів стало можливим після використання чотирьохокису азоту. При пропусканні олефіну через рідку N2O4 або краще через його розчин в кисневмісних розчинниках в інтервалі від -10°C до 25°С проходять екзотермічні реакції утворення двох головних продуктів – динітропохідного і нітронітриту:
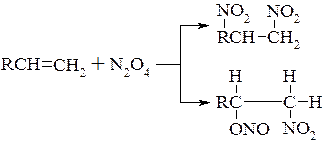
3.3. Нітрування ароматичних сполук.
Як і у випадку сульфування реакція нітрування має більш широке застосування для реакцій ароматичних сполук. Найчастіше в якості нітруючого засобу використовують нітруючу суміш, яку готують змішуванням азотної кислоти з концентрованою сірчаною кислотою. Часто вживають меланж, який представляє собою концентровану азотну кислоту, яка містить 7,5-9,0% сульфатної кислоти і до 4,5% води. Менш активним нітруючим реагентом може бути концентрована азотна кислота. До м’яких нітруючих агентів відносяться азотна кислота в суміші з оцтовою кислотою, ацетилнітрат або безводна азотна кислота в оцтовому ангідриді або льодяній оцтовій кислоті. Ацетил і бензоїл- нітратами можна нітрувати п’ятичленні гетероцикли. Найм’якішим реагентом є тетранітрометан в піридині, яким можна нітрувати навіть похідні бензену з двома електронодонорними замісниками.
Оригінальним препаративним методом нітрування ароматичних сполук, який запропонований недавно, є нітрування стабільними солями нітронія в розчиннику (ефір, сульфолан, тетраметиленсульфон) або без нього. Використання тетрафторбората нітронія в сульфолані дозволило легко з виходами 80-95% отримати нітробензен, алкілнітробензени, моно- і дигалогеннітробензени. Успішно нітруються також заміщені бензену, які містять електроноакцепторні замісники, хоча реакція протікає дещо повільніше і при більш високій температурі.
Важливим фактором є температура, при якій ведеться нітрування; для кожного процесу існує максимально допустима температура. Вже незначне підвищення рекомендованої температури різко підсилює окислюючу дію азотної кислоти, що звичайно проявляється в виділенні оксидів азоту. Практично нітрування проводять для ароматичних сполук при температурах від 0 до 100°С. Реакція дуже екзотермічна, протікає зі значним виділенням тепла. При введенні однієї нітрогрупи виділяється порядку 154 кДж/моль тепла. Тепло виділяється також при розбавленні сульфатної кислоти водою, яка утворюється в реакції. Тому при проведенні нітрування для підтримки необхідної температури забезпечують інтенсивний відвід тепла і повільну придачу реагентів. Нітрування часто йде в гетерогенному середовищі, тому дуже важливим є постійне і ретельне перемішування.
Присутність в вихідній ароматичній сполуці електроноакцепторної нітрогрупи різко знижує реакційну здатність цієї сполуки в реакціях ЕлЗа і зменшує швидкість введення другої нітрогрупи на 5-7 порядків. Тому при нітруванні звичайно високі виходи мононітросполук, а виходи динітросполук невеликі.
Після закінчення нітрування з реакційної маси, яка в основному складається з нітросполук і відпрацьованої сульфатної кислоти, необхідно виділити нітросполуку і очистити її.
Для відділення рідких (нітробензен, нітротолуен, нітрохлорбензени) або низькоплавких (нітронафтален, динітробензен, динітрохлорбензен) продуктів нітрування, які нерозчинні в відпрацьованій сірчаній кислоті, використовують сепаратори. Іноді для кращого відділення нітросполук реакційну масу попередньо розбавляють водою.
Багато нітросполук розчиняються в концентрованій сірчаній кислоті і не розчиняються в розведеній кислоті. Такі нітросполуки, наприклад нітрозаміщені ациламіни, при розбавленні реакційної маси водою випадають в осад і можуть бути відфільтровані.
Якщо нітропродукт не вдається виділити розбавленням реакційної маси, використовують висолювання, добавляючи в реакційну масу хлорид натрію, сульфат натрію і інші солі. Цей метод звичайно використовують при виділенні нітросульфокислот і нітрокарбонових кислот. Хлорид натрію можна добавляти при відсутності в кислій масі азотної кислоти. Для цього попередньо використовують метод денітрації – нагрів розбавленої водою реакційної маси.
Нітрозаміщені ароматичних сульфокислот і особливо полісульфокислот іноді вдається виділити переведенням їх в кальцієві солі.
Найбільш важкою частиною препаративної роботи є звичайно розділення ізомерної суміші, особливо орто- і пара-ізомерів, які часто отримуються в майже рівних кількостях. Для розділення рідких нітросполук, які киплять без розкладу, можна використати вакуум-перегонку.
Ізомерні нітросполуки можна розділити за допомогою виморожування (кристалізації), ректифікації, а також перекристалізації з розчинника при умові різної розчинності в них ізомерних нітропродуктів. Для вибору способу розділення необхідно знати фізичні властивості ізомерів (температуру плавлення і кипіння, розчинність), а також склад ізомерної суміші. Як правило, пара-ізомери мають більш високу температуру плавлення і при кристалізації виділяються в твердому вигляді в першу чергу. Поєднанням методів перегонки, ректифікації і кристалізації вдається розділити суміші ізомерних нітросполук на індивідуальні ізомери.
3.3.1 Нітрування бензену.
Нітруванням бензену отримують нітробензен і мета-динітробензен:
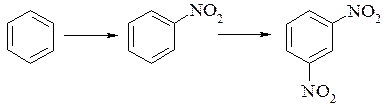
Для отримання нітробензену бензен нітрують нітруючою сумішшю, яка містить 0,97-1,01моль азотної кислоти на 1моль бензену; бензен, який не вступив в реакцію (якщо використовували недостачу азотної кислоти) відганяють з водяною парою. Нітрування проводять при температурі реакційної маси 50-60°С. Реакційну масу охолоджують, на сепараторі відділяють сирий нітробензен, його промивають водою і нейтралізують аміачною водою або карбонатом натрію.
Введення другої нітрогрупи проходить значно важче. Мета-динітробензен звичайно отримують нітруванням нітробензену або нітруванням бензену нітруючою сумішшю, яка містить 33% азотної кислоти і 67% сульфатної кислоти. Азотну кислоту беруть з невеликим надлишком (до 10%). Нітрування починають при 10-30°С, а закінчують при 80-90°С. Отриманий продукт містить 90% мета-ізомера, 8-9% орто- і 1-2% пара-ізомера. Для розділення ізомерів сирець обробляють розчином сульфіту натрію. При цьому орто- і пара-ізомери переходять в солі відповідних сульфокислот і переходять в розчин.
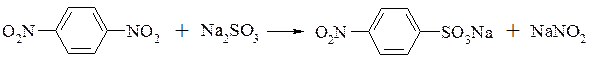
мета-Динітробензен в цих умовах не взаємодіє з сульфітом натрію.
мета-Динітробензен використовують для отримання м-нітроаніліну, м-фенілендіаміну, м-дихлорбензену.
3.3.2. Нітрування толуену.
Наявність в молекулі толуену групи СН3 приводить до більш легкого нітрування. Нітруючу суміш беруть нижчої концентрації, ніж у випадку бензену. Нітрування толуену починають при 25°С і закінчують при 35-40°С. При цьому утворюється суміш, яка містить 57% орто-ізомера, 38% пара- і 5% мета-ізомера. Отриману суміш розділяють за допомогою ректифікації і кристалізації.

3.3.3. Нітрування хлорбензену
Введення в молекулу бензену атома хлору приводить до появи від’ємного індуктивного і позитивного мезомерного ефекту. Нітрування хлорбензену проходить в 7-8 разів повільніше, ніж нітрування бензену, а нітрогрупа вступає переважно в орто- і пара-положення до атому хлору. Нітрування ведуть еквімолярною кількістю азотної кислоти в нітруючій суміші складу: азотна кислота 35,5%, сульфатна кислота 52,5%, вода 12%. Нітрування починають при 20-50°С і закінчують при 80°С. Отримана суміш містить 30% орто-, 70% пара-ізомерів, кількість мета-ізомеру не перевищує 1,5%. Для зменшення виходу орто-нітрохлорбензену нітрування проводять в дві стадії: при 55-60°С (I) і 70-75°С (II). Отриману суміш розділяють за допомогою ректифікації і кристалізації. Пара-нітрохлорбензен використовують для отримання п-нітроаніліну, п-нітрофенолу, п-фенітидіну і інших. Орто-нітрохлорбензен використовують для отримання о-нітроаніліну.
3.3.4. Нітрування гідроксисполук
Нітрування фенолу можна здійснити розбавленою кислотою. Для запобігання процесів окислення і осмолення при використанні концентрованих кислот фенол попередньо сульфують, отримують 4-гідроксибензен-1,3-дисульфокислоту. Надалі при дії азотної кислоти в присутності концентрованої сульфатної кислоти утворюється 4-гідрокси-5-нітробензен-1,3-дисульфокислота, а надалі при дії азотної кислоти в розбавленій сірчаній кислоті проходить заміщення сульфогруп нітрогрупами. Таким чином можна отримати пікринову кислоту (2,4,6-тринітрофенол).
3.3.5. Нітрування ароматичних амінів
Аміногрупа в ароматичній аміносполуці полегшує протікання реакції нітрування. Одночасно йдуть побічні процеси окислення. Крім того при проведенні нітрування в сильнокислому середовищі аміногрупа переходить в амонієву, що приводить до зміни орієнтації при заміщенні, тому перед нітруванням аміногрупу ацилюють і нітрують вже N-ацильне похідне аміну. Для ацетилювання використовують мурашину або оцтову кислоту.

Нітрування N-ациламіну проводять нітруючою сумішшю в середовищі сульфатної кислоти при низькій температурі (біля 0°С). Так у випадку N-ацетиланіліну його розчиняють в концентрованій сірчаній кислоті і при охолодженні нижче 0°С поволі прибавляють азотну кислоту. При цьому в основному утворюється п-нітроацетанілід з домішкою до 10% орто-похідного. Розбавленням реакційної маси виділяють нітропродукт, розділяють ізомери. В п-нітроацетаніліді ацетильну групу можна видалити нагріванням з розбавленою кислотою або лугом.
Аналогічно здійснюють нітрування інших ароматичних амінів.
3.3.6. Нітрування нафталену і нафталенсульфокислот.
У випадку нафталену електрофільне заміщення, в тому числі нітрування, протікає значно легше, ніж для бензену. Це зумовлено більшою можливістю делокалізації заряду в σ-комплексі.
Нафтален попередньо суспендують в сірчаній кислоті при 30-35°С, потім нітрують нітруючою сумішшю при 60-62°С, використовуючи незначний надлишок азотної кислоти (1-3%). При цьому в основному утворюється 1-нітро-нафтален; в якості побічних продуктів – 4,5% 2-нітронафталену і до 3,5% 2,4-ди-нітронафтолу-1. Нітропродукт відділяють в нагрітому стані, промивають водою і розчином соди, при цьому частково відмиваються і домішки.
Отриманий 1-нітронафтален містить домішки 2-нітронафталену, який при відновленні дає канцерогенний 2-амінонафтален. До цього часу не розроблено достатньо ефективного методу видалення 2-нітронафталену.
При подальшому нітруванні 1-нітронафталена утворюється суміш 1,8- і 1,5-динітронафталенів. Ізомерні динітронафталени можна розділити перекристалізацією з органічних розчинників, так як 1,5-динітронафтален розчиняється гірше, ніж 1,8-ізомер.

Велике практичне значення мають багаточисельні нітронафталенсульфокислоти, які звичайно отримують нітруванням нафталенсульфокислот, а не сульфуванням нітронафталенів. При цьому використовують суміш азотної кислоти і відпрацьованої кислоти, яка залишилася в сульфомасі при сульфуванні нафталену. Зрозуміло, що введення кількох сульфогруп затрудняє реакцію нітрування. Тому, якщо при нітруванні нафталенмоносульфокислоти надлишок азотної кислоти не допускається, то при нітруванні нафталендисульфокислоти азотна кислота береться з надлишком біля 10%, а при нітруванні нафталентрисульфокислот – з надлишком 15-20%. Для зняття надлишку азотної кислоти використовують денітрацію.
При нітруванні нафтален-1-сульфокислоти нітрогрупа вступає в α-положення другого кільця з утворенням 5-нітро- і 8-нітронафтален-1-сульфокислоти в співвідношенні приблизно 1:2. Розділення ізомерів звичайно проводять після відновлення.
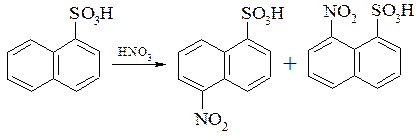
Нітрування нафтален-2-сульфо-кислоти приводить до утворення приблизно в рівній кількості 5-нітро- і 8-нітронафтален-2-сульфокислот. Отримують після відновлення кислоти Клеве, які можна використовувати без розділення.
Використання методів сульфування і нітрування в поєднанні з відновленням, лужною плавкою дає можливість отримати цілу гаму напівпродуктів для синтезу в першу чергу барвників.
Читайте також:
- V Ідентифікація, раціоналізація, проекція, інтроекція, агресія, зворотна реакція та їх комплекси.
- VI Реакція вуглеводневого адикалу
- VІ – харчова реакція (пиття).
- А — позитивна умовна реакція натискання на клавішу, В — бурхлива емоційно-рухова реакція за відсутності харчового підкріплення сигналу.
- Антропогенні впливи та реакція геосистем на них
- Берестейська церковна унія 1596 року і реакція на неї в українському суспільстві.
- Екологічний фактор - будь – який елемент або умова середовища, на які організми реагують пристосувальними реакціями (адаптацією).
- Закон збереження маси речовин. Закон збереження і перетворення енергії в хімічних реакціях.
- Ідеологічна реакція
- Нітрування
- ОБМІН ГАЛОГЕНІВ. РЕАКЦІЯ ФІЛЬКЕНШТЕЙНА.
- Патологічний стан, патологічний процес, патологічна реакція.
| <== попередня сторінка | | | наступна сторінка ==> |
| Реакції введення сульфогруп. | | | Реакції нітрозування. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |