
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції введення сульфогруп.
До реакцій, які дозволяють ввести сульфогрупу відносяться:
– сульфування (сульфонування) – введення в молекулу органічної сполуки сульфогрупи за допомогою наступних способів:
- заміщення атому водню при дії сульфатної кислоти або олеуму:

- введення молекули сірчистого ангідриду в зв’язок вуглець-водень:

– відновлювальне сульфування – перетворення ароматичних нітросполук в орто- або пара-аміносульфокислоти під дією бісульфіту з наступним кислотним гідролізом:

– сульфамінування – заміщення атому водню в амінах на сульфогрупу при дії хлорсульфонової або сульфамінової кислоти:

– сульфатування (сульфоетерифікація) – отримання ефірів сульфатної кислоти за допомогою:
- заміщення атому водню гідроксильної групи в молекулі спирту на сульфогрупу:
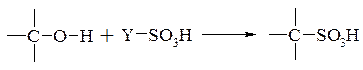
– сульфоокислення (сульфооксидування, сульфооксилювання) введення сульфогрупи в молекул аліфатичної сполуки при дії сірчистого ангідриду і кисню:
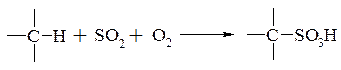
– хлорсульфування (сульфохлорування, хлорсульфонування) введення хлорсульфонільної групи в молекулу органічної сполуки шляхом заміщення атому водню за допомогою:
- взаємодії алканів і циклоалканів з сірчистим газом і хлором при дії УФ-світла або в присутності каталізаторів в темряві:
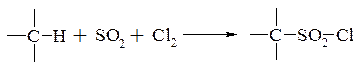
- взаємодією ароматичних сполук з хлорсульфоновою кислотою:

- взаємодія з сульфурилхлоридом:

Як видно з приведених прикладів реакція введення сульфогрупи, в основному, використовується при синтезі ароматичних сполук. Реакція сульфування – одна з найбільш важливих реакцій електрофільного заміщення в ароматичних сполуках. В результаті цієї реакції атом водню ароматичних сполук заміщується сульфогрупою і утворюються ароматичні сульфокислоти.
Сульфування проводять для надання ОС розчинності в воді, кислотних властивостей, а також з метою наступного заміщення сульфогрупи гідроксигрупою або, значно рідше, аміногрупою і атомом хлору (для антрахінону).
2.1. Вплив замісника на орієнтацію заміщення.
2.1.1. Статистичні фактори.
Для розуміння характеру утворення продуктів при взаємодії ароматичного субстрату з неорганічним реагентом дещо зупинимося на характеристиці субстрату. Молекула бензену – плоский правильний шестикутник, і π-електрони розміщені в молекулі рівномірно. Але вже в монозаміщених бензену симетрія π-електронів порушена і електрофільна частинка атакує в таких молекулах переважно місця з найбільшою електронною густиною. На характер напрямку атаки електрофільної частинки мають вплив статистичні, динамічні і кінематичні фактори.
Як правило статистичні і динамічні фактори діють неузгоджено, заміщення проходить з утворенням енергетично більш вигідного σ-комплексу, так як вирішальну роль в цих випадках відіграють динамічні фактори.
До статистичних факторів відносять індукційний і мезомерний ефект. До динамічних чинників відносять енергетичну вигідність утворення в момент реакції того або іншого σ-комплексу. До кінематичних чинників відносять реакційну здатність реагенту.
Класифікація замісників. По впливу на реакційну здатність бензеньного ядра замісники звичайно ділять на орієнтанти I і II роду. До орієнтантів I роду відносять замісники, які полегшують входження другого замісника і орієнтують його переважно в орто- і пара-положення відносно групи Y. До орієнтантів II роду відносять замісники, які затруднюють входження другого замісника і направляють його переважно в мета-положення відносно групи Y. Але ця класифікація не враховує галогени.
Класифікація стає більш загальною, якщо враховувати вплив обох ефектів. Тоді замісники можна класифікувати наступним чином:
– перша група – замісники, які полегшують протікання реакції електрофільного заміщення:
- замісники, які мають +І ефект і не мають +М-ефекту. До цієї групи відносяться алкільні групи, які направляють електрофільний замісник переважно в орто- і пара-положення і дещо полегшують його входження.
- замісники, які мають незначний -І ефект, і великий +М ефект. Сюди відносяться групи –OH і –OAlk, –NH2, –NHAlk і –N(Alk)2. Ці замісники значно пришвидшують реакції електрофільного заміщення і направляють новий замісник в орто- і пара-положення.
– друга група – замісники, які утруднюють протікання реакції електрофільного заміщення:
- замісники, які мають великий -І ефект і невеликий +М ефект. Сюди відносяться галогени. Внаслідок великого від’ємного індукційного ефекту галоїди затрудняють протікання реакції ЕлЗа, але направляють ЕлфРе відповідно до динамічних факторів в орто- і пара-положення.
- замісники, які мають -І і +М ефекти. Сюди відносяться групи –NO, –CN, –COAlk, –CHO, –COOR, –CON(Alk)2. Ці замісники сильно затруднюють протікання реакції ЕлЗа і направляють замісник переважно в мета-положення.
- замісники, які мають -І ефект і +М ефект рівний нулю. Сюди відносяться групи –N(CH3)2, –CCl3. Ці замісники сильно затрудняють протікання реакцій ЕлЗа і направляють замісник в мета-положення.
Крім перелічених п’яти типів замісників є групи змішаного характеру, які мають одночасно як +І, так і -І ефект, але М ефект яких рівний нулю. Сюди відносяться групи –CH2–NO2, –CH2Cl, –CHCl2, –CH2OH. Ці замісники дещо сповільнюють реакцію ЕлЗа і дають в різних співвідношеннях суміші трьох ізомерів.
2.1.2. Кінематичні фактори.
Ця класифікація дозволяє передбачити напрямок атаки ЕлЗа в залежності характеру вже наявного замісника, але залишає без уваги той факт, що і властивості реагенту теж мають певний вплив на характер орієнтації. Чим більш реакційноздатний реагент, тим в меншій мірі впливає різниця в реакційній здатності окремих атомів на хід заміщення, так як реагент приносить з собою основну частину енергії, яка необхідна для реакції. Висока реакційна здатність реагенту приводить до низької селективності реакції.
Розглянемо приклад. В якості еталону вимірювання служить відношення швидкостей, з якими електрофільно заміщується більш реакційноздатний толуен і менш реакційноздатний бензен (kT/kБ=К). Так при бромуванні вільним бромом в оцтовій кислоті при 25°С К=606 і утворюється тільки 0,3% мета-толільного похідного; при нітруванні азотною кислотою в нітрометані при 30°С К=20,5 – 3,8%; трет-бутилювання в присутності бромистого галію в толуені при 25°С К=1,6 – 32,7%. Відповідно при ЕлЗа в ароматичному ядрі з мета-орієнтуючими групами отримують тим більш процентний вміст орто- і пара-похідних, чим більш реакційноздатний реагент. Аналогічний вплив на селективність реакції має і температура проведення реакції, особливо у випадку зворотних реакцій, як у випадку сульфування. Існує правило для зворотних реакцій, що чим легше йде пряма реакція, тим легше йде і зворотня реакція. Тому проведення сульфування при підвищеній температурі приводить до збільшення вмісту мета-ізомеру. Крім того на місце вступу другого замісника має вплив просторовий фактор, які мають важливу роль особливо для орто-заміщення. Зі збільшенням розміру першого і другого замісника кількість орто-ізомера зменшується. Так при хлоруванні толуену співвідношення орто- і пара-ізомерів рівне 1,5; для третбутилбензену понижується до 0,28; а при ізопропілюванні третбутилбензену продукт орто-заміщення не утворюється взагалі.
2.1.3. Дизаміщені бензену.
Розглянемо орієнтацію для випадку дизаміщених бензену. Розрізняють узгоджену і неузгоджену орієнтацію.
– узгоджена орієнтація
- знаки мезомерних ефектів замісників співпадають, а самі вони займають один відносно іншого мета-положення. Тоді, якщо замісники мають +І ефект заміщення йде в орто-положення до однієї з груп, а якщо мають -І ефект в мета положення до замісників.


м-хлоранізол м-ціаннітробензен
- - мета-хлоранізол – в орто- і пара-положення до метоксигрупи;
- - мета-ціаннітробензен – в мета положення;
- знаки мезомерних ефектів протилежні, але значення не рівні нулю, а замісники займають орто- або пара-положення. Тоді новий замісник вступає в орто-положення (при пара-розміщенні) до електронодонорного замісника і мета положення до електроноакцепторного.
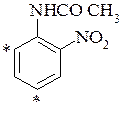

о-нітроацетанілід n-гідроксибензальдегід
- - орто-нітроацетанілід – в орто-пара-положення до ацетаміногрупи;
- - пара-гідроксибензальдегід – в орто-положення до гідроксигрупи.
– неузгоджена орієнтація
- знаки мезомерного ефекту замісників протилежні, а самі замісники займають один відносно другого мета-положення, тоді напрямок заміщення визначає замісник з +М ефектом:
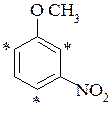
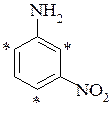
м-нітроанізол м-нітроанілін
- - мета-нітроанізол – вступає в орто- і пара-положення до метоксигрупи;
- - мета-нітроанілін – в орто- і пара-положення до аміногрупи;
- знаки мезомерного ефекту замісників позитивні, і розташовані в орто- або пара-положеннях, тоді питання про переважне заміщення вирішує відносна сила замісників

n-хлордиметиланін
- - пара-хлор-диметиланілін – в орто-положення до аміну. По мірі росту мезомерного ефекту групи можна розставити в ряд:
–I< –Br<–Cl < –F < –OR < –OH < –NH2 < –NHAlk < –N(Alk)2 < –O–
- - якщо замісник має +І ефект і М=0, тоді у випадку неузгодженої орієнтації вони поступаються всім замісникам з +М ефектом, навіть галоїдам, і тому ЕлЗа в орто-хлортулуолі переважно йде в пара-положення до хлору. Але у випадку пара-хлортолуену, де пара-положення зайняте, заміщення йде переважно в мета-положення до хлору;
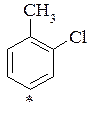

о-хлортолуен n–хлортолуен
- знаки мезомерного ефекту обох замісників від’ємні, а розміщені в орто- або пара-положеннях. Тоді ЕлЗа йде надзвичайно важко, а питання орієнтації вирішується з врахуванням відносної електроноакцепторної сили замісників:
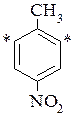
n-нітротолуен
- - пара-нітротолуен – в мета положення до нітрогрупи.
Сила замісників з -М ефектом збільшується в ряду:
–COOC2H5 < –CN < –COCH3 < –CHO < –NO2
2.1.4. Орієнтація заміщення в нафталені.
Коротко зупинимося на орієнтації заміщення в нафталеновому ряді. Конденсовані ароматичні системи при порівнянні з бензеном більш реакційно здатні в реакціях ЕлЗа. Крім того вони проявляють більшу тенденцію до реакцій приєднання на відміну від бензену. В переважній кількості реакцій електрофільний реагент атакує в молекулі нафталену α-вуглецевий атом, що можна пояснити динамічними факторами. Було вирахувано, що енергія активації при атаці β-вуглецевого атому на 3-4ккал/моль більша ніж при утворенні σ-комплексу за рахунок α-вуглецевого атому.
Для продовження розгляду заміщення в нафталеновому ряді приведемо означення розміщення замісників: орто-(1,2), мета-(1,3), пара-(1,4), ана-(1,5), епі-(1,6), ката-(1,7), пері-(1,8) для α-заміщених і амфі-(2,6), прос-(2,7) для β-заміщених.
При наявності в а-положенні електронодонорного замісника заміщення йде переважно в орто- і пара-положення. А при наявності електроноакцепторного замісника в α-положенні заміщення йде в ана- або пері-положення (для NO2). Електронодонорний замісник в β-положенні орієнтує заміщення в орто-α-положення. Електроноакцепторний замісник в β-положенні орієнтує заміщення в амфі-, прос- положення, або з утворенням епі-похідного. Введення третього замісника носить складний характер і виходить за межі даного курсу.
2.2. Практика проведення сульфування.
Перейдемо до розгляду реакції сульфування. На відміну від більшості реакцій ЕлЗа в ароматичному ряду реакція сульфування зворотна.

В результаті реакції виділяється вода, і рівновага буде зміщуватися вліво, тому в якості сульфуючого агента використовують сульфатну кислоту у вигляді купоросного масла (92-93%), моногідрату (98-100%), олеуму (20-25% або 60-65% з вмістом вільного триоксиду сірки відповідно 20-25 і 60-65%); хлорсульфонову кислоту, триоксид сірки, солі сірчистої кислоти в присутності окислювачів, речовини, які містять зв’язаний триоксид сірки і здатні його виділяти (піридинсульфотриоксид). В деяких випадках вода видаляється азеотропною (толуен, ЧХУ) або вакуумною перегонкою.
Введення в молекулу ароматичної сполуки електроноакцепторної групи SO3H, яка має -І і -М ефекти, затрудняє подальше сульфування. Константа швидкості введення першої і другої сульфогрупи відрізняються приблизно на 3 порядки, тобто швидкість реакції зменшується в ряду сполука-моносульфо-дисульфопохідне. Тому в залежності від умов сульфування можна отримувати сульфокислоти з певною кількістю сульфогруп. Умови проведення сульфування вибирають таким чином, щоб отримати максимальний вихід цільового продукту і мінімальну кількість побічних продуктів. З цією метою використовують сірчану кислоту різної концентрації, змінюють температуру і тривалість реакції, а також використовують каталізатори.
Швидкість реакції сульфування лінійно залежить від концентрації сульфатної кислоти. При розбавленні сульфатної кислоти водою, яка виділяється під час реакції, швидкість реакції може зменшуватись настільки, що реакція практично зупиняється. Концентрацію сульфатної кислоти (яку виражено в відсотках триоксиду сірки), при якій сульфування вже практично не йде, називають π-сульфування. Воно залежить від природи вихідної сполуки, кількості сульфогруп, які вводять в молекулу, і температури сульфування.
Найбільш ймовірними електрофільними частинками в реакції сульфування є молекула SO3 або її протонована форма HOSO2+.
Так як електровід’ємність сірки складає величину 2,5; кисню – 3,5, тоді на атомі сірки в молекулі SO3 є великий дефіцит електронної густини. Тому триоксид сірки виявляється здатним сульфувати ароматичні сполуки, навіть в апротонних розчинниках при відсутності сульфатної кислоти. Це дає основу вважати, що SO3 є не тільки сульфуючим агентом, але і акцептором протону при завершенні реакції.
Практично сульфування в залежності від природи вихідної речовини і кількості сульфогруп, які вводяться, проводять при температурах від -20оС до +200оС (частіше всього при 60-110оС). В залежності від температури сульфування сульфогрупа може вступати в різні положення ароматичної сполуки. Так, при сульфуванні фенолу на холоду переважно утворюється орто-фенолсульфокислота, а при підвищеній температурі – пара-фенолсульфокислота. При нагріванні орто-фенолсульфокислоти утворюється пара-фенолсульфокислота.
Особливо яскравим є вплив температури при сульфуванні нафталену. При сульфуванні моногідратом при низькій температурі (30-60°С) в якості основного продукту утворюється нафтален-1-сульфокислота (біля 85%) і невелика кількість (до 15%) нафтален-2-сульфокислоти; при високій температурі (160°С) переважно утворюється нафтален-2-сульфокислота (85%). Якщо отримати спочатку нафтален-1-сульфокислоту, сульфуючи нафтален при низькій температурі, а потім реакційну масу нагріти до 160°С, тоді кількість нафтален-1-сульфокислоти зменшується, а кількість нафтален-2-сульфокислоти збільшується, так як нафтален-1-сульфокислота гідролізується легше.
Тривале нагрівання сульфомаси, яка містить в основному нафтален-1-сульфокислоту і при низькій температурі приводить до утворення значної кількості 2-ізомера. Це пояснюється зворотністю реакції сульфування, а також тим, що одночасно протікають дві паралельні реакції.
При низькій температурі швидкість сульфування нафталену в положення 1 в кілька разів вища, ніж в положенні 2. Через більшу схильність нафтален-1-сульфокислоти до гідролізу порівняно з нафтален-2-сульфокислотою збільшення витримки приводить до збільшення вмісту нафтален-2-сульфокислоти.
На практиці сульфування проводять в металічних апаратах – сульфураторах, які споряджені сорочками для охолодження або обігріву. Порядок придачі компонентів реакційної суміші залежить від природи вихідної ароматичної сполуки і умов сульфування. При сульфуванні при підвищеній температурі сірчану кислоту добавляють до розплавленої вихідної сполуки. На холоду, як правило, субстрат добавляють до сульфатної кислоти.
Полісульфокислоти частіше всього отримують ступеневим сульфуванням; сульфуючий агент добавляють в кілька прийомів, змінюючи його концентрацію і температуру сульфування, тобто створюють оптимальні умови для проведення другого і третього сульфування. Після придачі всієї кількості сульфуючого агенту реакційну масу перемішують при певній температурі.
Для виділення сульфокислоти використовують різні методи. Вибір методу залежить від властивостей сульфокислоти. Деколи сульфокислоту виділяють розбавленням реакційної маси холодною водою або виливають її на лід. Однак більшість сульфокислот виділяють у формі їх солей, переважно натрієвих, іноді кальцієвих. Солі сульфокислот, як правило добре розчинні у воді, але виділяються в осад при надлишку солі того металу, який утворює сіль сульфокислоти, такий метод називається висолюванням. Висоленню піддають як сульфомаси, які розбавлено водою, так і розчини солей сульфокислот, які отримали при нейтралізації сульфомаси. Для висолення використовують хлорид або сульфат натрію. Хлорид більш дешевий, але при його взаємодії з концентрованою сульфомасою може виділятися хлористий водень, який викликає корозію апаратури.
Часто для виділення сульфокислот у вигляді солей сульфомасу нейтралізують, добавляючи соду, крейду, гідроксид або сульфіт натрію. Нейтралізація сульфітом натрію особливо зручна і вигідна в тих виробництвах, де отримані солі сульфокислот надалі використовують в процесах лужної плавки (наприклад при отриманні фенолу через бензенсульфокислоту і 2-нафтолу з нафтален-2-сульфокислоти). В цьому випадку використовують сульфіт натрію, який отримують в процесі лужної плавки. А двоокис сірки, який утворюється при виділенні, використовують для виділення відповідної гідроксисполуки:
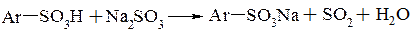

2.2.1. Сульфування бензену.
Сульфування бензену було розроблено для виробництва фенолу. Отриману таким чином сульфокислоту при дії лугу і наступного підкислення переводили в фенол. Для сульфування бензену використовують великий надлишок сульфатної кислоти. Для зменшення витрат сульфатної кислоти при сульфуванні бензену процес ведуть при високій температурі з одночасним видаленням реакційної води. Такий метод називають методом сульфування в парах. Згідно цього методу бензен нагрівають до 150-160°С, барботують через купоросне масло. Бензен беруть в 5-6 кратному надлишку. Надлишок бензену виносить з апарата воду. Сульфування припиняють при вмісті в реакційній масі 4-5% сульфатної кислоти, яка не вступила в реакцію. Зменшення кількості вільної кислоти може привести до утворення сульфонів.
Введення двох сульфогруп в молекулу бензену протікає значно важче, з меншою швидкістю. Процес можна вести в одну або в дві стадії, що краще. Спочатку при 50–80°С бензен сульфують моногідратом, на другій стадії сульфують 65%-ним олеумом при 30–80°С. Солі бензен-1,3-дисульфокислоти добре розчинні в воді, не висолюються. Сульфомасу виливають в розчин сульфату натрію, нейтралізують карбонатом кальцію, сульфат кальцію відфільтровують. Розчин бензен-1,3-дисульфокислоти упарюють досуха. Отриману кислоту переробляють в резорцин.
2.2.2. Сульфування толуену.
При сульфуванні толуену реакція сульфування протікає легше ніж у випадку бензену. При цьому утворюються орто- і пара-ізомери. Ізомерний склад залежить від умов проведення сульфування. Так при сульфуванні толуену 82,3% сірчаною кислотою при 25°С утворюється 65,1% пара-толуенсульфокислоти. При підвищенні концентрації сульфуючого агенту до 95,3% збільшується вміст орто-ізомера до 50%, а при сульфуванні триоксидом сірки в хлороформі підвищується вміст пара-ізомера до 91%. При високих температурах співвідношення толуенсульфокислот визначається термодинамічними факторами: переважно отримують більш стабільний мета-ізомер. Так при сульфуванні толуену 74%-ною сірчаною кислотою при 141°С суміш містить 59,6% мета-ізомера, 37,2% пара-ізомера і 3,2% орто-ізомера.
Кількість пара-ізомера збільшується до 85%, якщо сульфування вести в парах з одночасною відгонкою води. Чиста пара-толуенсульфокислота може бути отримана при сульфуванні толуену 98%-ною сірчаною кислотою в присутності гідросульфату калію.
2.2.3.Сульфування амінів.
При сульфуванні ароматичних первинних амінів використовують еквімолярні кількості сульфатної кислоти. Сіль ароматичного аміну з сірчаною кислотою, яка утворюється на початку реакції, методом запікання при 180-190°С переводять в аміносульфокислоту.

Метод запікання проводять в тунельних печах або в присутності висококиплячих розчинників – поліхлорбензенів.
2.2.4. Сульфування фенолу.
При сульфуванні фенолу купоросним маслом і моногідратом утворюється суміш орто- і пара-ізомерів. Співвідношення ізомерів залежить від температури сульфування. При 0-5°С кількість орто-ізомера складає 40%, при підвищенні температури до 100°С кількість орто-ізомера зменшується до 10%. При обробці фенолу, взятого в надлишку, купоросним маслом або моногідратом при температурі до 180°С отримують 4,4-дигідроксидифенілсульфон:
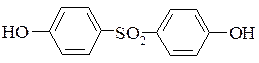
2.2.5. Сульфування хлор - і нітробензенів.
Сульфування хлорбензену протікає з меншою швидкістю, ніж у випадку бензену. Сульфування ведуть моногідратом або олеумом при 80-100°С. При цьому утворюється практично тільки п-хлорбензенсульфокислота.
Нітробензен, а також інші нітрозаміщені, як і слід очікувати, сульфуються важче, ніж бензен. Наявність сильної електроноакцепторної групи понижує електронну густину на бензеньному ядрі, що зменшує швидкість реакції. Для сульфування нітрозаміщених використовують олеум.
Сульфування нітрозаміщених проводять при температурах, які не перевищують 100-110°С, при неперервному перемішуванні. При більш високих температурах можливі процеси окислення, які протікають з виділенням великої кількості тепла, що може привести до вибуху. Обов’язковим є загрузка нітросполуки в олеум, а не навпаки. Передбачається умова швидкої евакуації реакційної маси при підвищення температури.
При сульфуванні п-нітрохлорбензену утворюється 5-нітро-2-хлорбензенсульфокилота, яка широко використовується. п-Нітрохлорбензен розчиняють при 80°С в 20%-ному олеумі і надалі сульфують при 107-110°С 65%-ним олеумом. По закінченні реакції сульфомасу виливають в воду, охолоджують, висолюють сульфокислоту сульфатом натрію.
2.2.6. Сульфування нафталену.
При сульфуванні нафталену утворюється як нафтален-1-сульфокислота, так і нафтален-2-сульфокислота. Для нафталену теоретично можливе існування десяти ізомерів дисульфокислот. При сульфуванні нафталену розміщення сульфогруп підпорядковується правилу Армстрога-Вінна, згідно якого не утворюються сульфокислоти, в яких сульфогрупи розміщені в орто-, пара- і пері-положеннях один відносно іншого. Відповідно до цього можливе утворення шести ізомерних нафталендисульфокислот (1,3-, 1,5-, 1,6- 1,7-, 2,6- і 2,7-), трьох нафталентрисульфокислот (1,3,5-, 1,3,6- і 1,3,7-) і 1,3,5,7-нафталентетрасульфокислоти.
В α-положення нафталену сульфогрупа вводиться звичайно при сульфуванні з використанням більш концентрованого сульфуючого агенту при більш низькій температурі і меншій тривалості реакції, ніж при введенні сульфогрупи в о-положення. В цих умовах сульфогрупа більш стійка до гідролізу.
Нафтален-1-сульфокислоту отримують сульфуванням нафталену моногідратом при 60°С. При цьому утворюється до 15% 2-ізомера. Продукт реакції може бути виділений у вигляді натрієвої солі розбавленням сульфомаси
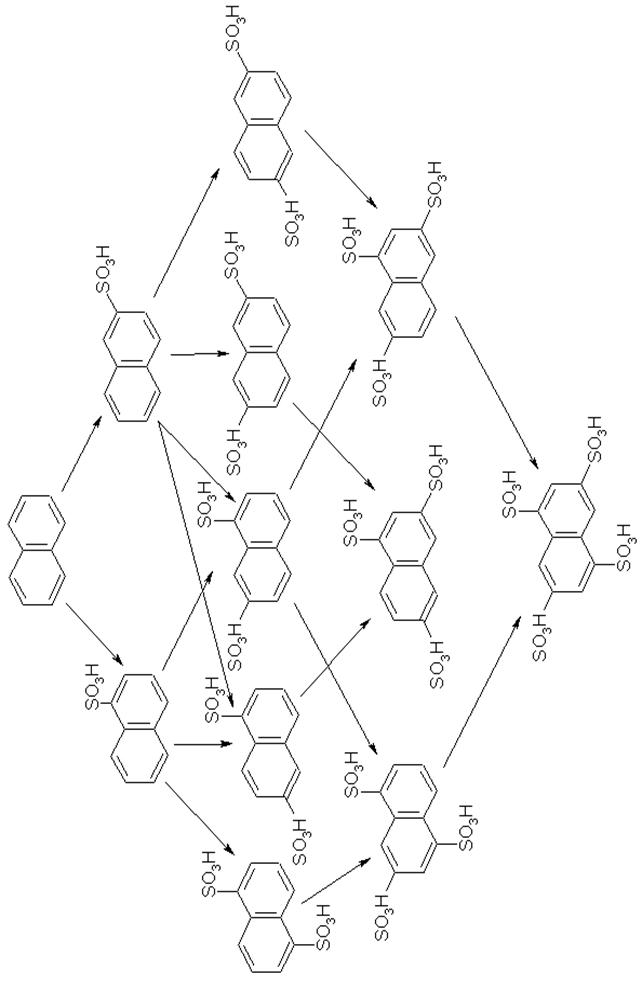
водою, нейтралізацією гідроксидом кальцію, а потім карбонатом натрію. Однак, в більшості випадків нафтален-1-сульфокислоту не виділяють, а реакційну масу відправляють на подальше нітрування.
Сульфування нафталену до нафтален-2-сульфокислоти має більше практичне значення, так як використовується для отримання багатотоннажного продукту – 2-гідроксинафталену. Сульфування проводять при 160-165°С з використанням купоросного масла.
Необхідно відмітити, що швидкість сульфування в α-β-положення змінюється в залежності від концентрації сульфатної кислоти і температури реакції. Так, при 25°С відношення констант швидкостей сульфування в α- і β-положення змінюється від 5,9:1 (75%-ній сірчаній кислоті) до 4,1:1 (в 95%). При підвищенні температури це співвідношення зменшується. Так при сульфуванні в 95,2%-ній сірчаній кислоті при 0,5°С 5,2:1, а при 70°С 3,3:1.
2.2.7. Сульфування 2-нафтолу.
При сульфуванні 2-нафтолу можна отримати як моно-, так і дисульфокислоти, які знаходять широке застосування. Таким чином можна отримати 2-гідроксинафтален-1-сульфокислоту:
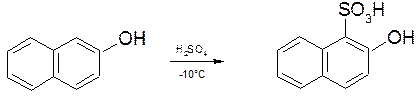 (оксикислота Тобіаса)
(оксикислота Тобіаса)
6-гідроксинафтален-2-сульфокислоту:
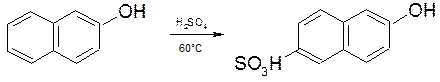 (кислота Шеффера)
(кислота Шеффера)
7-гідроксинафтален-1-сульфокислоту:
 (кроцеїнова кислота)
(кроцеїнова кислота)
7-гідрокснафтален-1,3-дисульфокислоту:
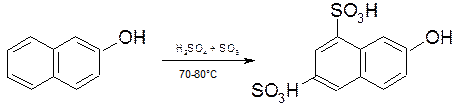 (Г-кислота)
(Г-кислота)
3-гідроксинафтален-2,7-дисульфокислоту:
 (Р-кислота)
(Р-кислота)
і інші.
2.2.8. Сульфування парафінів.
На відміну від сульфування ароматичних сполук сульфатна кислота не реагує з парафінами. По цій причині для введення сульфогрупи в насичену молекулу довгий час користувалися іншими реакціями, наприклад приєднання бісульфіту натрію до карбонільних сполук і α-окисів:


В присутності перекисей утворюються сульфокислоти:

Також можлива заміна атому хлору в хлорпохідних при дії сульфіту натрію

Важливими реакціями для введення сульфогрупи в насичені вуглеводні є:
– сульфохлорування парафіну сірчистим ангідридом і хлором при освітленні
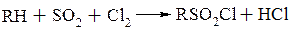
– сульфоокислення парафіну сірчистим ангідридом при опроміненні або присутності ініціаторів радикально-ланцюгових реакцій:

Реакції проводяться при м’яких умовах, температура до 40°С.
Реакція сульфування має велике практичне значення. Використовується для:
– заміни на групи ОН і CN сплавленням відповідно з твердими лугами і ціанистим калієм.
– сульфогрупу можна видалити нагріванням при 135-200°С з розбавленою сірчаною кислотою. Ця реакція використовується для тимчасового блокування певних місць бензеньного кільця. Наприклад, якщо необхідно отримати 2,6-дибромфенол, тоді доцільно спочатку сульфувати фенол при 100°С, провести бромування п-фенолсульфокислоти, а потім видалити сульфогрупу:
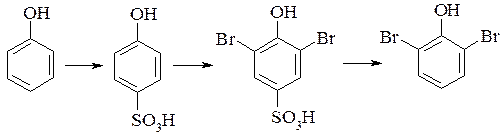
– сульфогрупу можна замінити дією концентрованої азотної кислоти на нітрогрупу. Ця реакція використовується для отримання пікринової кислоти з фенолу:
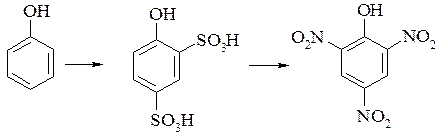
Читайте також:
- I. Введення в розробку програмного забезпечення
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- Адаптація персоналу: цілі та завдання. Введення у посаду
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналіз факторів і причин відхилень від плану введення виробничих потужностей і основних фондів
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- ВВЕДЕННЯ
- Введення
- Введення
| <== попередня сторінка | | | наступна сторінка ==> |
| Класифікація органічних реакцій. | | | Реакція нітрування (нітрації). |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |