
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТЕМА: АТОМНЕ ЯДРО
ПЛАН
1. Будова атомних ядер.
2. Дефект маси та енергія зв’язку.
3. Ядерні сили.
4. Феноменологічні моделі ядра.
5. Закон радіоактивного розпаду.
6. Ядерні реакції.
7. Реакція ядерного поділу. Ланцюгова реакція.
8. Термоядерні реакції; керовані термоядерні реакції.
1. Заряд ядра визначається числом позитивних зарядів (протонів), які знаходяться у ядрі. Оскільки атом у цілому електронейтральний (qa=0), а заряд електронної оболонки = - Zе, де е – заряд електрона, а Z – кількість електронів, тоді заряд ядра дорівнює:

е = 1,6 . 10-19 Кл,
Z – порядковий номер елемента у таблиці Менделєєва.
Оскільки маса електрона дуже мала: m = 9,1 . 10-31 кг, то в ядерній фізиці вводять позасистемну одиницю для маси, яку називають атомна одиниця маси (АОМ).
1 АОМ = 1,66 . 10-27 кг
За 1 АОМ приймають 1/12 маси ізотопу вуглецю 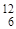 С.
С.
Ізотопи хімічних елементів – це ядра, які мають однаковий заряд, але різну масу, ізобари – навпаки. Введемо поняття масового числа А.
А–ціле число, найближче до маси атома, яке дорівнює кількості нуклонів (протонів, нейтронів) у ядрі.
Символічний запис позначення ядра

На основі експериментів із розсіюванню швидких нейтронів на ядрах різних хімічних елементів було проведене оцінювання розмірів ядра: r~ 10-15м. Густина ядерної речовини дуже велика і не йде ні в яке порівняння зі звичайними величинами: r ~ 1017 кг/м3. До складу ядра, як ми знаємо, входять протони, що визначають його позитивний заряд. А як же бути з масою речовини, яка залишилась (A-Z)?
Тоді, в свій час, було зроблено припущення про те, що до складу ядра входять електрони (протонно-електронна модель ядра). Однак ця модель з її висновками суперечила існуючим експериментальним фактам. У 1933 році англійський фізик Чєдвік установив, що при бомбардуванні ядер атомів різними частками виникає дуже проникливе випромінювання, яке складається з незаряджених часток. Так був видкритий нейтрон. А Іваненко і Гапон створили протонно-нейтронну модель ядра. Тоді N = A - Z.
N – кількість нейтронів у ядрі.
Тепер зрозуміло, що ізотопи відрізняються кількістю нейтронів.
Водень має три ізотопи:
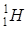 (протій) – протон
(протій) – протон
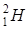 (дейтерій) –дейтон
(дейтерій) –дейтон
 (тритій) – тритон.
(тритій) – тритон.
2. Оскільки ядро – стійка структура, то між нуклонами ядра повинен існувати певний зв’язок.
Читайте також:
- Банківська система: сутність, принципи побудови та функції. особливості побудови банківської системи в Україн
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- Банківська система: сутність, принципи побудови та функції. Особливості побудови банківської системи в Україні.
- ЛЕКЦІЯ 2.ТЕМА: ФІЗІОЛОГІЯ МІКРООРГАНІЗМІВ
- Лекція 3.Тема: Мікробіологічні основи екології навколишнього середовища.
- Лекція 4. ТЕМА: Найважливіші біохімічні процеси збудниками яких є мікроорганізми
- Лекція 6. Тема: Географія сфери послуг
- Лекція № 17. Тема: Робочий час і час відпочинку.
- ЛЕКЦІЯ № 2 Тема: Загальне вчення про хворобу.
- Лекція № 2. Тема: ПРЕДМЕТ І СПЕЦИФІКА ХУДОЖНЬОЇ ЛІТЕРАТУРИ.
- Лекція № 21. Тема: Заробітна плата.
- Лекція № 6. Тема: Правова організація працевлаштування громадян.
Переглядів: 1191
| <== попередня сторінка | | | наступна сторінка ==> |
| ЛЕКЦІЯ ХХIV | | | Повна енергія зв’язку (DЕзв.)–фізична величина, що дорівнює роботі, яку потрібно виконати для розщеплення ядра на складові його нуклони. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |