
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Суміш рівних об’ємів бензолу і води кипить при 69,2° С.
План лекції
1. Загальна характеристика «летких отрут».
2. Методи ізолювання речовин з біологічного матеріалу.
3. Загальна схема аналізу дистилятів хімічними методами.
1. Загальна характеристика «летких отрут»
«Леткі отрути» - це токсичні речовини, які ізолюються дистиляцією або перегонкою з водяною парою: синильна кислота; оцтова кислота; галогенпохідні аліфатичного ряду (хлороформ, чотирихлористий карбон, дихлоретан, хлоралгідрат); альдегіди і кетони (формальдегід, ацетон); спирти (метиловий, етиловий, ізоаміловий, етиленгліколь); складні ефіри (оцтово-етиловий, оцтово-аміловий ефір); ароматичні вуглеводні і їх похідні (бензол, толуол, ксилол, анілін); феноли і фенолокислоти (фенол, саліцилова кислота), плюмбум етилований; сульфурокарбон, фосфор і речовини, отримані після його окислювання (фосфорні кислоти) і відновлення (фосфористий гідроген).
Летальні дози для деяких «летких отрут»:
НСN- 0,05-0,1 г;
СН3OH-25-100 г (7-8 г-сліпота);
СНС13 - 50-70 г,
СН3СООН-15г.
Зазначені речовини є високо токсичними, вони доступні, так як. широко використовуються в промисловості, сільському господарстві, медицині. Наприклад, у медицині застосовуються хлороформ, етанол, фенол, ефір; у сільському господарстві - циклони В і С (для боротьби зі шкідниками); на заводах і фабриках - бензол, ацетон і інші органічні розчинники.
Загальні властивості «летких отрут» - здатність переганятися з водяною парою незалежно від змішуваності з водою. Цей метод дозволяє створити більш м'які умови для виділення зазначених речовин з біологічного матеріалу, тому що деякі речовини можуть осмоляться, розкладатися при високих температурах.
В основі цього методу лежить залежність тиску насиченої пари суміші від температури. Рідина починає кипіти і буде переганятися, якщо тиск пари над рідиною буде дорівнювати або більшим за атмосферний тиск.
Σ Р1 + Р2... = Рп>Ратм, де
ΣР1 + Р2... - сума парціальних тисків парів води і рідини;
Рп - тиск парів над сумішшю.
Отже, суміш буде переганятися при температурі нижчій, ніж самі речовини:
tкип С6Н6 - 80,2° С
tкип Н2О - 100°С
2. Методи ізолювання речовин з біологічного матеріалу.
У судово-хімічних лабораторіях ізолювання «летких отрут» з біологічного матеріалу здійснюють методом перегонки (дистиляції) з водяною пароюза методикою: 100г біологічного матеріалу подрібнюють, змішують з дистильованою водою (Vсуміші = 1/3 Vколби) і поміщають у колбу, яку ставлять у холодну водяну баню. Потім нагрівають пароутворювач до появи водяної пари, досліджувану суміш підкислюють насиченим водним розчином щавлевої або винної кислоти до рН 2-2,5 і негайно з'єднують усі частини: пароутаорювач, колбу, холодильник і приймач, потім нагрівають водяну баню.
Вибір рНобумовлений тим, що рН - 2-2,5 забезпечує найбільш повне руйнування зв'язку білка і речовин.
Вибір кислотобумовлений тим, що мінеральні кислоти можуть розкладати «леткі отрути», наприклад, синильну кислоту:
НСN + 2Н2О + Н+ ® НСООН + NH4 +
або викликати утворення отруйних речовин при дослідженні біологічного матеріалу, наприклад, в результаті гниття білка в організмі утвориться сульфатнокислий ефір фенолу:
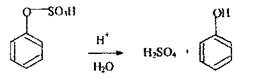
Слабкі органічні кислоти ефір не руйнують, переганяється фенол, що надходить в організм ззовні з токсичною метою. Прикладом використання мінеральних кислот в якості підкислюючого агенту при ізолюванні «летких отрут» є дистиляція оцтової кислоти, для чого в біологічний матеріал вводять Н2 SО4 або H3РО4, тому що кислоти зcувають рівновагу в розчині вбік утворення молекулярної форми оцтової кислоти, яка повністю переганяється з водяною парою.
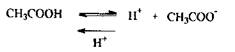
Збір дистилятів роблять у приймач. Перший дистилят, що містить найбільш леткі отрути, а саме, НСN, збирають у розчин лугу -2 % розчином NаОН 2 мл; V1 дистиляту = 5 мл. Потім збирають ще 2 дистиляти:
V2 = V3= 25мл
Якщо отримано позитивний результат при дослідженні на «летку отруту», то дистиляцію проводять доти, поки дистилят не перестане давати якісну реакцію. Зібрані дистиляти досліджують потім якісно і кількісно.
Ряд речовин основного характеру переганяють з підлужненого біологічного матеріалу: анілін, пірідин, нікотин, анабазін і інші. У цьому випадку після перегонки речовин з підкисленого біологічного матеріалу, його підлужнюють 5 % розчином NaОН до рН 8-9 і знову переганяють, збираючи 2-4 дистиляту по 10-15 мл в 0,1 Мрозчин НС1.
Усі «леткі отрути» поділяються за здатністю змішуватися з водою:.
1. Речовини, що не змішуються або погано змішуються з водою (бензол, хлороформ) дають після перегонки два чітких шари: вода і речовина, що легко розділити.
2 Речовини, що дають з водою суміші, у яких склад пари і рідини однаковий (фенол, етанол) - азеотропні суміші - у дистиляті не розділяються. Для розділення азеотропних сумішей використовують перегонку при пониженні або підвищені тиску (азеотропна суміш етанолу з водою 96 % C2Н5ОН + 4% Н2О - переганяється при атмосферному тиску при 78о С. При пониженні тиску до 100мм при дистиляції суміш має склад -99,62 % С2Н5ОН + 0,4 % Н2О і переганяється при 34о С.
Якщо після перегонки з водяною парою вміст отрут у дистилятах малий або попадають речовини, що утворилися після гниття біологічного матеріалу, то для очищення дистиляти піддають фракційній перегонці.
Метод сухоповітряного відгону застосовується для аналізу проб крові, сечі, невеликих наважок гомогенізованих органів.
Метод сухоповітряного відгону проводять у закритих камерах або бюксах, на дно яких поміщають аналізовану пробу і ставлять тигель з поглинальним розчином. Відбувається зникнення отрути в присутності висолювача або без нього - при кімнатній температурі або при нагріванні (37-50° С) у поглинальний розчин, з яким надалі проводять якісні реакції.
При проведенні лабораторного експрес-аналізу крові, сечі, промивних вод шлунку живих осіб при гострих інтоксикаціях використовується метод парофазного аналізу, що полягає в аналізі пароподібної фази за допомогою методу газової хроматографії, попередньо перевівши отрути в пароподібний стан, а далі роблять поділ і детектування їх.
3. Загальна схема аналізу дистилятів хімічним методом.
Аналіз починають з першого дистиляту на наявність синильної кислоти. Фізичні властивості - це рідина без кольору, запаху гіркого мигдалю, летуча, t кипіння - 25,6° С.
Дуже слабка кислота Кд = 4,8 · 1010, солі її у воді нестійкі:
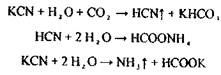
Синильна кислота дуже токсична Летальні дози синильної кислоти і її солей: НСN = 0,05-0,1 г, КСN = 0,15-0,25 г.
Синильна кислота уражає дихання, тобто блокує дихальний фермент - цитохромоксидазу, при цьому кисень від гемоглобіну не надходить в тканини.
HCN + білок – R—Fe3+ → білок – R-Fe3+ - CN + H
цитохромоксидаза стійкий комплекс
Метаболізмсинильної кислоти протікає в двох основних напрямках - гідроліз з утворенням форміату амонію і перетворення ціанід- іону в роданід-іон під дією ферменту роданази.
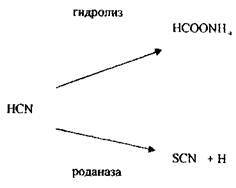
Антидоти при отруєнні синильною кислотою: I Сірковмісні речовини - тіосульфати натрію, калію.
роданаза
HCN + S2O32- + O → SCN + SO42-
2 Речовини, що утворюють метгемоглобін - солі та ефіри азотистої кислоти NаNО2, КNО2, С5Н11-О-NО (аміловий ефір), метиленовий синій.
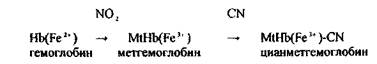
Але СN--іон може відщеплюватись, тому необхідно вводити хворому одночасно сірковмісні речовини і вуглеводи.
3 Вуглеводи (глюкоза) - зв'язують синильну кислоту і її солі з утворенням ціангідрину глюкози.
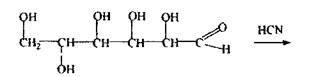
глюкоза
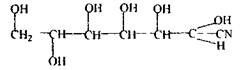
ціангідрін глюкози
Особливості ізолювання синильної кислоти з біоматеріалу:
Враховуючи, що синильна кислота легко летка і мало дисоціює у воді, її зв'язують у сіль:
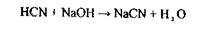
|
Аналіз дистиляту на синильну кислоту починають з попередньої, високочутливої і специфічної реакція утворення берлінської блакиті:

Особливості проведення реакції - у лужному середовищі можливі побічні реакції утворення - Fе(ОН)2 ↓ , Fе(OН)3 ↓, для їхнього розчинення вводять НС1:
Fе(ОН)3 + 3НС1 —> FеС13 +3Н2О, однак надлишок НС1 - сповільнює випадання осаду.
Висновок про наявність отрути дають через 24-48 годин, тому що якщо є сліди HCN і якщо є білкові речовини, то осад утворюється повільно. Для прискорення його випадання вводять ВаС12 і на осаді ВаSО4 співосаждується осад берлінської блакиті.
У судово-слідчі органи направляється осад берлінської блакиті.
Чутливість реакції 20 мкг у 1 мл розчину.
Для підтвердження наявності синильної кислоти в дистиляті проводяться реакції забарвлення:
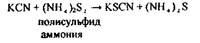
|
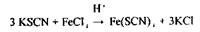
|
Реакція утворення роданіду заліза - високочутлива (10 мкг у 1 мл), але неспецифічна.
кроваво-червоний кольор розчину
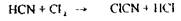
|
Реакція утворення поліметину високочутлива (0,2 мкг у 1 мл розчину), неспецифічна.
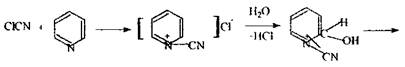
|
хлорциан
 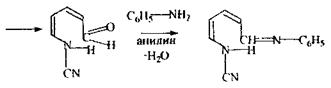
|
піридин ціан-піридинія хлорид перегрупіровка в молекулі
ціан-проізводне
глутаконового
альдегіду
Реакція утворення бензидинової сині -чуттєва, неспецифічна:
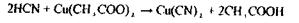
діциан
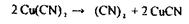
|
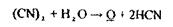
|

|
бензидинова синь
Папір, змочений розчином солі міді і бензидином, синіє при наявності синильної кислоти або її солей.
Аналіз другого дистиляту починають з дослідження отрутних галогенопохідних аліфатичного ряду, летальні дози для яких такі:
Хлороформ – СНСl3 = 50-70 г
Чотирихлористий карбон - СС14 = 20-50 мл
Хлоралгідрат
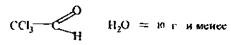
|
Дихлоретан

По токсичній дії:
• Хлороформ і хлоралгідрат_є наркотиками. Вони спочатку збуджують, а потім паралізують нервову систему.
• Чотирихлористий карбон діє на організм подібно хлороформу, але повільніше і викликає значні порушення в органах, у печінці, нирках спостерігається жирове переродження.
• Дихлоретан по наркотичній дії є найсильнішим з отрутних галоїдпохідних.
• Поразка цими речовинами супроводжується блювотою, проносом, здуттям живота, збільшенням і болючістю печінки, анурією.
Метаболізм вивчений недостатньо, кінцевим результатом метаболітчних процесів є диоксид карбону і хлористоводнева кислота:
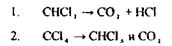
|
Особливістю ізолюваннягалогенпохідних отрут аліфатичного ряду є здатність переганятися вже в перші порції дистиляту. При значних кількостях отрут (> 1г) у дистиляті спостерігаються краплі рідини , які не змішуються з водою.
Аналіз починають іззагальної (неспецифічної) і низькочутливої реакції відщеплення органічно зв'язаного хлору, що дають усі галоїдопохідні.

|
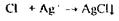
| (4 години нагрівають в ампулі запаянной) |
Спостерігається білий осад або біле помутніння в розчині.
Якщо не спостерігається помутніння або осад, то проводиться реакція Фуджівара,яка базується на утворенні поліметину – чутлива, неспецифічна.
Реакція утворення ізонітрилу - високочутлива, неспецифічна, з досліджуваних галогенпохідних тільки дихлоретан не дає даної реакції.
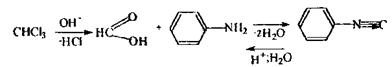
|
З'являється неприємний запах. При позитивному результаті виконується повний аналіз на галогенпохідні отрути.
Реакція з резорцином у лужному середовищі - чутлива; неспецифічна - її можуть давати альдегіди, мурашина кислота.
Механізм недостатньо встановлений.
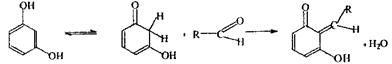
|
Енольна кето-форма
форма
Спостерігається рожеве забарвлення розчину.
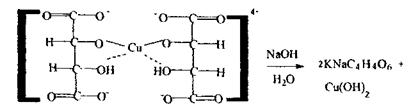
Реакція відновлення гідрокису купруму - низькочутлива і неспецифічна (альдегіди), чотирихлористий карбон і дихлоретан не дають зазначеної реакції.
|
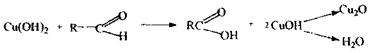
Реакція з реактивом Несслера- характерна для хлоралгідрату.
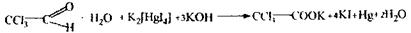
Спостерігається оранжевий осад, який з часом стає зеленим.
На наявність дихлоретану виконується цілеспрямований аналіз:
Реакція відщеплення атомів хлору:
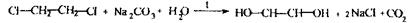
|
Спостерігається білий осад хлориду аргентуму після додавання нітрату аргентуму в нітратнокислому середовищі.
Реакція утворення етиленгліколю і виявлення його після переведення у формальдегід:
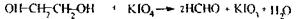
|
Реакція утворення ацетиленіду купруму:
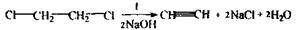
|

|
Спостерігається рожеве або вишнево-червоне забарвлення розчину.
Потім другий дистилятдосліджується на наявність формальдегіду, летальна доза якого складає 15-25 мл.
Формальдегідпоражає дихання, викликаючи при вдиханні різкий кашель, сльозотечу. Попадання формальдегіду через рот супроводжується нудотою, судорогами, втратою свідомості, поражає нирки, паралізує дихання.
Метаболізмформальдегіду протікає за таким механізмом:
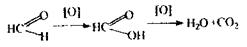
Аналіз формальдегідупочинають із проведення високочутливих реакцій:
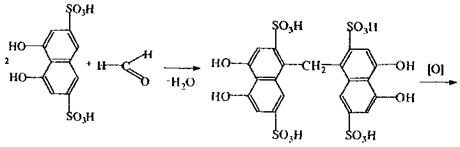
|
Реакція з хромотропною кислотою,в результаті якої спостерігається фіолетове або червоно-фіолетове забарвлення розчину. Реакція неспецифічна, тому що її дають речовини, що при гідролізі, дегідратації або окислюванні утворюють формальдегід.
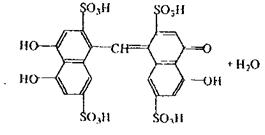
|
Реакція кодеїну та сульфатною кислотою,в результаті якої спостерігається синьо-фіолетове або червоно-фіолетове забарвлення.
кодеїн морфін
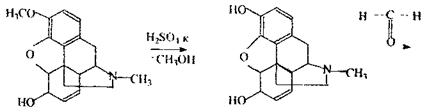
|
Реакція з фуксинсірчистою кислотою - реакція неспецифічна, тому що її дають альдегіди (фурфурол, ацетальдегід і інші) і навіть окислювачі
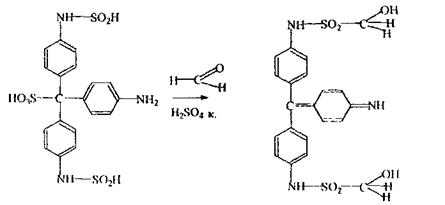
|
повітря (хлор, кисень, окиси нітрогену). Синій колір з'являється в розчині не відразу, а через 10-15 хв. Однак, якщо колір з'явився через півгодини, то це не є позитивним результатом на альдегід.
Слід зазначити, що за певних умов ця реакція може бути специфічна для формальдегіду, тому що йде при сильно кислому середовищі рН = 0,7 тільки з формальдегідом; а при рН - 2,7 - дають багато альдегідів.
Реакції з резорцином; відновлення іонів аргентуму; з реактивом Фелінга- менш чутливі і неспецифічні, але вони виконуються обов’язково, якщо позитивний результат високочутливих реакцій.
При відсутності позитивного результату на формальдегід виконують реакції на метиловий і етиловий спирти, а потім на кетони - ацетон.
З аліфатичних спиртів найбільше токсикологічне значення мають метиловий, етиловий і ізоаміловий спирти.
Спирти використовуються в медицині, на хімічних заводах, у харчовій промисловості. Денатурат (.технічний спирт) включає 2,5 % ацетоністого спирту (75 % метанолу і 0,5 % піридинових основ).
Летальна доза метилового спирту40-100 мл, при прийомі 7-8 мл метанолу в хворого наступає сліпота. Токсична діяметилового спирту полягає в пораженні нервової системи, судинної системи, зорового нерву, сітківки ока. Метанол діє на гемоглобін і блокує перенесення кисню, що викликає настання гіпоксії. Метанол кумулюється.
Токсичність метанолузумовлена продуктами метаболізму - формальдегідом і мурашиною кислотою:
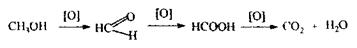
• Формальдегід поражає зоровий нерв.
• Мурашина кислота приводить до сильного ацидозу.
Антидотомпри поразці метиловим спиртом є етиловий спирт, що легше розкладається ферментом алкогольдегідрогеназою, а метанол виводиться нирками, легенями в менш токсичному, нативному стані.
Особливості ізолювання: метанол леткий і для зменшення втрат його збирають у збірник, охолоджений льодом або холодною водою.
При дослідженні вин попередньо зв'язують леткі кислоти карбонатом натрію, а потім відганяють метанол.
При аналізі дешевих одеколонів попередньо очищують одеколон від ефірних олій, екстрагуючи олії ефіром, а потім зв'язують леткі кислоти й відганяють метанол.
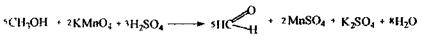
|
Аналіз метилового спиртупочинають з попередньої реакції -окислення метанолу до формальдегіду:
Для зв'язування окислювача додають щавлеву кислоту або сульфіт натрію.

Формальдегід виявляють по реакції з розчином кодеїну в сульфатнокислому середовищі або з фуксинсірнистою кислотою.
Реакція утворення складного ефіру - підтверджуюча, неспецифічна, тому що її дає й етиловий спирт, однак одержання метилсаліцилату в 40 разів чутливіше, ніж одержання етилсаліцилату.
Летальні дози для етилового спирту - 100-150 г (250-275 мол горілки) для неп’ющої людини, 15-25 г - для дітей.
Етиловий спирт поражає нервову систему, серцево-судинну, викликає цироз печінки, психози.
Локалізація спирту - у мозку, печінці, нирках. Спирт - наркотик, що збуджує, а потім пригнічує нервову систему.
90 % від введеної дози етилового спирту окислюється до Н2О і СО2 під дією алкогольдегідрогенази і 10 % виводиться легенями, нирками.
В організмі людини в нормі виробляється ендогенний спирт (0,002 ‰ - 0,004 ‰) в результаті окислювання вуглеводів вищих спиртів, розпаду білкових речовин.
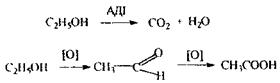
|
Метаболізм етилового спирту :
При введенні лікарських речовин- антабуса або ціаміду - затримується процес окислювання ацетальдегіду до оцтової кислоти, що приводить до нагромадження ацетальдегіду, що супроводжується нудотою, блювотою, головним болем і викликає відразу до алкоголю.
Аналіз етилового спирту починають з попередньої, неспецифічної реакції утворення йодоформу, що дають ацетон, молочна кислота:
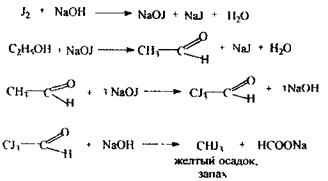
За позитивним результатом реакції проводять підтверджуючі дослідження на етиловий спирт і ацетон.

|
Реакція утворення оцтово-етилового ефіру - підтверджуюча, специфічна - запах оцтово-етилового ефіру.
Запах ефіру підсилюється при розведенні у воді.
Реакція утворення ацетальдегіду підтверджуюча, специфічна,
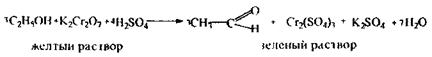
|
запах оцтового альдегіду
Реакція утворення етилбензоату - підтверджуюча, специфічна - запах етилового ефіру бензойної кислоти.

Летальні дози для ацетону - 25-50 мл.
Ацетон в малих кількостях в нормі міститься в сечі людини - 20-25 мг, тому що є одним з нормальних метаболітів нашого організму. При захворюваннях - діабет - зміст ацетону зростає.
Метаболізм ацетону:
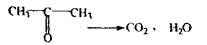
Особливістю ізолюванняацетону є виділення ацетону з дистиляту, тому що ацетон змішується з водою, спиртом, ефіром у всіх співвідношеннях. Ацетон висолюють при насиченні дистиляту солями натрію хлориду, кальцію хлориду, калію карбонату, що приводить до утворення двох легкороздільних шарів- ацетону і води.
Аналіз на ацетонтакож починається з найбільш чутливої, неспецифічної реакції утворення йодоформу:

|
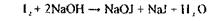
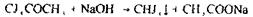
Характерний запах і наявність жовтого осаду вказують на можливість присутності ацетону в дистиляті.
Реакція з нітропрусидом натріює реакцією підтверджуючою, неспецифічною і характерною для кетонів.
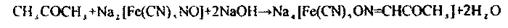
|
Читайте також:
- АРОМАТИЧНІ ВУГЛЕВОДНІ РЯДУ БЕНЗОЛУ
- Визначення розміру полів за допомогою розбиття статті на 9 рівних частин
- ВИХІДНИХ МАТЕРІАЛІВ ТА БЕТОННОЇ СУМІШІ
- Вкладання бетонної суміші.
- Властивості бетонної суміші і бетону
- Властивості і приготування бетонної суміші.
- Вплив розпилення на процес сумішоутворення.
- Газові закони. Суміш газів.
- Гендер як політика рівних прав і можливостей чоловіків та жінок, а також діяльність зі створення механізмів щодо її реалізації.
- Гомологи бензолу
- Дизаміщені бензолу.
- Забезпечення рівних шансів для всіх учасників
| <== попередня сторінка | | | наступна сторінка ==> |
| Операційний менеджмент як складова менеджменту організації. | | | Спостерігається червоне забарвлення розчину. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |