
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кінетика зворотних реакцій першого порядку
Інших реакцій.
Закону кінетики і проходить незалежно від
То кожна з них підпорядковується основному
Повне змінювання системи є сумою цих незалежних змінювань. Принцип незалежності не є абсолютно загальним, оскільки відомий вплив реакцій.
Найчастіше хімічні реакції не проходять до кінця, тобто еквімолярна суміш вихідних речовин не повністю перетворюється у кінцеві продукти реакції. У таких випадках реакція наближується до якогось рівноважного стану , який може бути заздалегідь обчислений на основі термодинамічних даних. Прикладами таких реакцій є утворення аміаку, йодоводню, багатьох окисно-відновних реакцій. Оборотність реакцій особливо помітна у тих випадках, коли константа рівноваги близька до 1. Якщо необхідно довести реакцію до кінця, то слід видаляти продукти реакції з рівноважної суміші.
Розглянемо, наприклад, простий випадок, коли реакції, що проходять у прямому та зворотному напрямках, мають перший порядок:
А 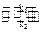 В.
В.
Нехай у початковий момент часу t = o, концентрації речовин А і В відповідно дорівнюють С0А і С0В , а у момент t концентрація речовини А дорівнює СА. Тоді відповідності до рівняння реакції концентрація речовини В у цей момент часу буде дорівнювати СВ = С0В+ (С0А – СА) і сумарна швидкість реакції, що дорівнює різниці швидкостей прямої та зворотної реакцій, буде
-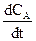 = k1CA – k2 [С0В+ (С0А – СА)], (10.1)
= k1CA – k2 [С0В+ (С0А – СА)], (10.1)
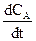 = k2(C0А + C0В) – CA (k1 + k2) =
= k2(C0А + C0В) – CA (k1 + k2) =
= (k1 + k2) [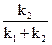 (C0А + C0В) – CA].
(C0А + C0В) – CA].
Уводимо позначення 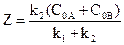 і
і
остаточно отримуємо
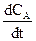 = (k1 + k2)(Z – CA). (10.2)
= (k1 + k2)(Z – CA). (10.2)
З інтегрування цього рівняння отримуємо
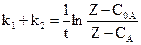 . (10.3)
. (10.3)
У момент рівноваги сумарна швидкість реакції дорівнює нулю і з (10.2) отримуємо Z = CpA , де СрА – рівноважна концентрація речовини А. З урахуванням цього
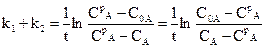 . (10.4)
. (10.4)
Отримане рівняння аналогічне до виведеного нами (9.3) рівнянню необоротної реакції першого порядку, тільки під знаком логарифма замість концентрацій стоїть різниця між концентрацією у даний момент часу і рівноважною концентрацією.
Із термодинаміки (6.2) відомий вираз для константи рівноваги К, яка у нашому випадку буде дорівнювати
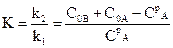 . (10.5)
. (10.5)
Спільне розв¢язання останніх двох рівнянь дає можливість визначити k1 i k2 :
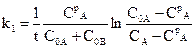 , (10.6)
, (10.6)
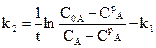 . (10.7)
. (10.7)
На рис. 10.1 подані змінювання концентрації речовин А і В у оборотній реакції першого порядку.
Реакцій такого типу досить багато, особливо у розчинах. До них належать реакції ізомеризації. Наприклад, реакція ізомеризації ціаніду амонію у сечовину у водному розчині:
NH4CNO Û (NH2)2CO.
Для оборотних реакцій більш високих порядків аналогічні міркування приводять до більш громіздких виразів, що подібні до відповідних рівнянь для необоротних реакцій того самого порядку.
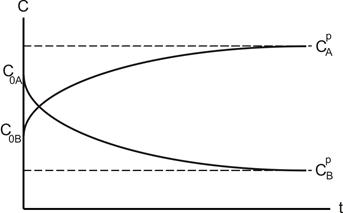
Рисунок 10.1 – Змінювання концентрацій реагентів у зворотних реакціях першого порядку
Читайте також:
- RLC-фільтр четвертого порядку
- Аспекти організаційного порядку
- Афінний шифр k-ro порядку.
- Байки першого періоду творчості (1850-1870 pp.).
- Бінарне відношення порядку.
- Верховна Рада України обирає із свого складу Голову Верховної Ради України, Першого заступника і заступника Голови Верховної Ради України та відкликає їх з цих посад.
- Вестфальский мир як основа європейського правопорядку 1648-1815 рр.
- Визначення опорних реакцій трьохшарнірної арки
- Визначення порядку черги фаз трифазної системи
- Визначення реакцій балки
- Визначення реакцій в’язей
- Визначники n-го порядку
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 10. Аналіз фінансових звітів | | | Порядку |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |