
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ХІМІЧНІ МЕТОДИ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ
Хімічні методи визначення вуглеводів базуються на окисненні вуглеводів, що містять вільну альдегідну або кетонну групу, певними хімічними реактивами – оксидами важких металів: оксидом міді, йодом, сполуками заліза та іншими сполуками. Оксиди металів окиснюючи цукри, відновлюються. Кількість відновленої речовини еквівалентна вмісту цукру в досліджуваному розчині. Саме ці методи переважно використовуються для визначення масової частки сахарози у готових виробах хлібопекарської, кондитерської, макаронної та харчоконцентратної промисловості.
Суть хімічних методів визначення сахарози у готових виробах полягає в переведенні сахарози в розчин, гідролізі сахарози з утворенням редукувальних сахарів і окисненні останніх оксидами важких металів або йодом у лужному середовищі. Серед металів як окисники використовують оксид міді (ІІ), оксид заліза (ІІІ). Найпоширенішими є методи, ґрунтовані на окисненні сахарів оксидом міді (ІІ): перманганатний метод (метод Бертрана), напівмікрометод ВНДІХП, метод гарячого титрування, які передбачені стандартом для визначення масової частки сахарози в булочних виробах, метод Лейна і Ейнона – у кондитерських виробах.
Для визначення вмісту цукру спочатку необхідно приготувати водну витяжку, в якій проводять гідроліз сахарози. Витяжку готують із тим розрахунком, щоб вміст цукру в ній був близько 0,5 %. Розрахунок наважки продукту проводять згідно формули:
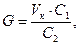 (3.1)
(3.1)
де G – маса наважки продукту, яка береться для приготування витяжки, г; Vк – геометричний об'єм мірної колби, в якій готується витяжка, см3;С1 – концентрація цукру в витяжці, % (рекомендується методикою визначення масової частки цукру і в залежності від методу аналізу може складати від 0,2 до 1,8 %); С2 – очікувана масова частка загального цукру або редукуючих речовин в продукті, %.
Наважка переноситься в мірну колбу за допомогою води. Для кондитерських виробів застосовується гаряча вода. При великій кількості цукру в наважці колба з сумішшю витримується у водяній бані при температурі 60 °С 15 хвилин для розчинення цукру. Суміш настоюється для екстракції розчинних речовин. Потім в колбу вноситься сульфат цинку, суміш перемішується і вноситься гідрооксид натрію. Протікає реакція в результаті якої утворюється гідрооксид цинку:
ZnSO4 + 2NaOH = Zn(OH)2 + Na2SO4 (3-2)
Гідрооксид цинку погано розчиняється у воді і утворюється драглеподібний осад. При цьому осаджуються також водорозчинні білки, декстрини, пентозани та інші речовини. Вони після гідролізу, який проводиться пізніше, також здатні взаємодіяти з реактивом Фелінга. Тому їх необхідно осадити для зменшення похибки аналізу.
Після внесення гідроксиду натрію і сульфату цинку об’єм рідини в колбі доводиться водою до мітки і рідина перемішується.
Суміш відстоюється і фільтрується через складчастий паперовий фільтр.
При визначенні масової частки загального цукру проводиться гідроліз цукрів витяжки. Частина фільтрату (частіше всього об’єм 50 см3) переноситься в чисту мірну колбу (як правило об’ємом 100 см3). В колбу вноситься соляна кислота. Колба з рідиною витримується на водяній бані при температурі витяжки 67– 70 °С протягом 5 хв і швидко охолоджується. В колбу вноситься індикатор метиловий оранжевий і рідина нейтралізується концентрованим лугом. При цьому рожевий колір переходить в жовто-рожевий. Після цього об’єм розчину в колбі доводиться дистильованою водою до мітки і перемішується. Всі операції при гідролізі повинні виконуватись в точній відповідності з вказаним режимом. При вищій температурі та більшій тривалості гідролізу починається розклад глюкози і фруктози. Особливо чутлива до нагріву в кислому середовищі фруктоза.
В результаті проведених операцій отримують витяжку в якій містяться редукуючі цукри, кількість яких еквівалентна загальному вмісту цукрів в продукті.
Основним реактивом, який використовується при визначенні масової частки цукру хімічними методами є реактив Фелінга. Він складається з двох реактивів. В перший реактив (Фелінг І) входить сульфат купруму, в другий (Фелінг ІІ) – сегнетова сіль (виннокислий калій-натрій) і луг (гідроксид натрію).
На першому етапі хімізм названих методів однаковий і полягає в тому, що як джерело оксиду міді (ІІ) використовують рідину Фелінга, яку одержують змішуванням двох розчинів: Фелінга І (розчину CuSO4) і Фелінга ІІ (лужного розчину тартрату калію-натрію – сегнетової солі). При змішуванні цих двох розчинів спочатку утворюється блакитний осад гідроксиду міді, який одразу розчиняється в результаті утворення комплексної сполуки міді й сегнетової солі (див. рівняння реакції (3-3) та (3-4)).
CuSO4+2NaOH=Cu(OH)2¯+Na2SO4; (3-3)
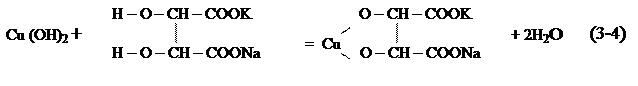 |
З цього видно призначення окремих речовин в реактиві Фелінга. Сульфат купруму використовується, як добре розчинна сполука в якій є двохвалентна мідь. Луг введено в склад реактиву для того, щоб сульфат купруму перевести в активну сполуку. Сегнетова сіль необхідна для утворення розчинної у воді сполуки міді.
Комплексна сполука нестійка і під час нагрівання в присутності редукувальних сахарів розпадається з утворенням окисника CuO. У результаті реакції з сахарами утворюється осад Cu2O, кількість якого еквівалентна кількості сахарів, що прореагували – рівняння (див. 3-5).
 |
Проте для реакції окиснення сахарів характерні різний ступінь окиснення й утворення різних продуктів окиснення, склад яких залежить від природи сахарів, умов проведення аналізу тощо. Крім того, реакція супроводжується побічними процесами – руйнуванням сахарів при нагріванні в лужному середовищі, їх окисненням під дією кисню повітря. Тому для визначення кількості сахарів за знайденою кількістю міді користуватись стехіометричним рівнянням не можна – потрібні спеціальні таблиці, складені дослідним шляхом для кожного методу і кожного виду сахарів.
У подальшому методи розрізняються способом визначення кількості міді, що вступила в реакцію окиснення сахарів.
В основу перменганатного метода Бертрана покладено визначення маси оксиду одновалентного купруму Cu2O, який випав в осад при взаємодії реактиву Фелінга з редукуючими цукрами. Маса осаду визначається методом взаємодії його з сполуками трьохвалентного феруму (шляхом титрування розчину перманганатом калію).
Осад Cu2O відокремлюють фільтруванням і визначають кількість оксиду міді (І). Для цього його розчиняють в кислому розчині сульфату заліза (ІІІ), який при цьому відновлюється до сульфату заліза (ІІ) і відтитровується перманганатом калію. Реакцію відтворюють рівняння (3.6) і (3.7):
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O; (3-6)
10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O. (3-7)
Знаючи кількість розчину перманганату калію, що пішла на титрування, і титр розчину за міддю, можна розрахувати кількість міді, відновленої під час окиснення сахарів. За спеціальними таблицями, складеними дослідним шляхом, за знайденою кількістю міді визначають кількість відповідного виду сахарів (сахарози або інвертних сахарів, мальтози, глюкози).
Особливу увагу треба звернути на методику визначення титру KMnO4 за міддю [1, с. 80].
Титр марганцевокислого калію можна обчислити, виходячи з наведених вище рівнянь реакції, й перевірити титруванням 0,4965 г щавлевої кислоти у присутності 10 см3 H2SO4 перманганатом [1, с. 80].
Коефіцієнт перерахунку щавлевокислого амонію на мідь можна розрахувати таким чином: виходячи з рівнянь (3-6) і (3-7) дві молекули перманганату калію (2KMnO4) відповідає десяти атомам міді (10Cu+). Водночас взаємодія перманганату калію з щавлевокислим амонієм при визначенні титру KMnO4 відбувається згідно з рівнянням:
2KMnO4+5(NH4)2C2O4+8H2SO4=2MnSO4+K2SO4+5(NH4)2SO4+10CO2+8H2O (3-8)
З цього можна зробити висновок:
1(NH4)2C2O4 ® 2Cu+;
М – 142,12; М=2·63,6.
Якщо відома маса m, г, відтитрованого перманганатом щавлевокислого амонію, кількість міді можна визначити з пропорції:
| 142,12 | – 2´63,6 |
| m | – х |
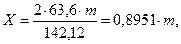
де 0,8951 – коефіцієнт перерахунку (NH4)2C2O4 на мідь.
Титр KMnO4 можна також встановити, титруючи свіжоперекристалізовану щавлеву кислоту чи щавлевокислий натрій, звільнений від гігроскопічної води. У цьому разі використовують коефіцієнти 1,0086 і 0,9488 відповідно для щавлевої кислоти та щавлевокислого натрію.
Метод Вільштеттера і Шудля грунтується на тому, що йод в лужному середовищі кількісно окиснює альдосахари у відповідні одноосновні кислоти, кетози при цьому не змінюються:
CH2OH(CHOH)4COH+J2+2NaOH = CH2OH(CHOH)4COOH+2NaJ+H2O (3-9)
Окислювальна дія лужного розчину йоду відбувається за схемою:
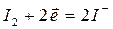
Надлишок йоду, що не вступив у реакцію з сахарами, відтитровується тіосульфатом натрію:
І2+2Na2S2O3=2NaІ+Nа2S4O6. (3-10)
За цим методом паралельно проводять контрольний аналіз. При цьому замість витяжки використовують дистильовану воду.
Витрата тіосульфату натрію в контрольному аналізі показує кількість йоду, яку було внесено в колбу на початку аналізу. Витрата тіосульфату натрію в робочому аналізі показує скільки йоду залишилось після реакції окиснення альдоз. Різниця між витратою розчину тіосульфату натрію на титрування в контрольному і робочому аналізі показує, яка кількість йоду витрачена на окиснення альдоз.
Цей метод застосовують для визначення глюкози (альдози) в присутності кетоз.
У напівмікрометоді ВНДІХП, у методі Шорля та інших визначають не кількість утвореного Сu2О, а кількість Cu2+, що не прореагувала. Для цього після реакції сахарів із розчинами Фелінга в реакційну колбу додають розчин йодистого калію і сірчану кислоту, внаслідок чого KІ окислюється до І2. Йод, що виділився, відтитровується тіосульфатом натрію Na2S2O3:.
2CuO+4KІ+ H2SO4=Cu2І2+І2+2K2SO4; (3-11)
І2+2Na2S2O3=2NaІ+Na2S4O6. (3-12)
Отже, кількість Na2S2O3, що пішла на титрування І2, еквівалентна кількості CuO, що не прореагувала. Для визначення тієї кількості міді, що прореагувала з сахарами, проводять контрольний дослід, в якому замість розчину цукру для реакції з розчинами Фелінга беруть відповідну кількість води. Далі визначення проводять, як і в робочому досліді. За різницею між кількістю Na2S2O3, що пішла на титрування І2 в контрольному і робочому дослідах, дізнаються про кількість міді (ІІ), що вступила в реакцію, і відповідну кількість цукру. 1 см3 0,1 моль/дм3 розчину Na2S2O3 відповідає 5,4 мг мальтози, 3,7 мг фруктози, 3,3 мг глюкози і 3,4 мг сахарози. Можна також скористатись таблицею, наведеною в праці [3, с. 291].
 |
Метод гарячого титрування заснований на здатності редукуючих сахарів відновлювати в лужному розчині Сu (II) в Cu (I) і полягає в тому, що лужний розчин міді (реактив Фелінга) у процесі кип’ятіння титрують розчином сахарів у присутності метиленової сині як індикатора. Хімізм взаємодії сахарів з реактивом Фелінга аналогічний викладеному вище. Але в розчині І міститься метиленова синь, яка надає синього забарвлення реакційній суміші доти, поки в розчині немає редукувальних речовин. Якщо в реакційну колбу попадає хоч одна надлишкова крапля редукувальних сахарів, метиленова синь переходить у безбарвну лейкосполуку за схемою:
 |
Спочатку визначають титр (Т) мідно-лужного розчину за сахарозою або кількість сахарів, еквівалентну 10 см3 мідно-лужного розчину, титруванням суміші розчинів І та ІІ стандартним розчином сахарози:
Т = 1,0·V, (3.3)
де V – об’єм стандартного розчину цукру, що пішов на титрування, см3; 1,0 – масова частка сахарози в 1 см3 стандартного розчину сахарози, мг.
Аналогічно виконують титрування досліджуваним розчином цукру. Треба зважати на те, що концентрація розчинів Фелінга І і Фелінга ІІ в цих методах відрізняється (табл. 1).
Таблиця 1
Читайте також:
- I визначення впливу окремих факторів
- II. Визначення мети запровадження конкретної ВЕЗ з урахуванням її виду.
- II. Мотивація навчальної діяльності. Визначення теми і мети уроку
- Ocнoвнi визначення здоров'я
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адміністративні (прямі) методи регулювання.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Адміністративні методи управління
- Адміністративні, економічні й інституційні методи.
- Адміністративно-правові (організаційно-адміністративні) методи мотивації
| <== попередня сторінка | | | наступна сторінка ==> |
| КЛАСИФІКАЦІЯ МЕТОДІВ ВИЗНАЧЕННЯ ВУГЛЕВОДІВ. СУТНІСТЬ ПОЛЯРИМЕТРИЧНОГО МЕТОДУ | | | ПИТАННЯ ДЛЯ САМОПЕРЕВІРКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |