
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кінетика ферментативних реакцій
Вивчаючи кінетику ферментативних реакцій, дослідники відзначили їх відмінність від звичайних хімічних реакцій. За малих концентрацій речовин, що вступають в реакцію, тобто субстрату, спостерігається закономірність, яка є характерною для звичайних хімічних реакцій: швидкість реакції пропорційна концентрації субстрату. При збільшенні концентрації субстрату швидкість реакції, як і в хімічних процесах, знаходиться в складній залежності від ряду причин. Однак при подальшому збільшенні концентрації субстрату швидкість ферментативної реакції стабілізується та припиняє залежати від концентрації субстрату. Це значить, що в процесі ферментативної реакції відбувається насичення ферменту субстратом.
Ферментативну реакцію можна зобразити в вигляді рівняння:
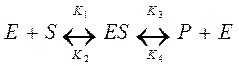 ,
,
де Е – фермент; S – субстрат; ES – фермент-субстратний комплекс; Р – продукт реакції.
Співвідношення К2/К1=КS має назву константи дисоціації.
Рівняння Міхаеліса-Ментена для визначення швидкості ферментативної реакції має вигляд:
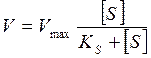 .
.
В подальшому Дж. Б. Холдейн та Д. Бріггс удосконалили залежність Міхаеліса-Ментена:
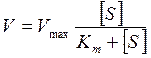 .
.
Це рівняння відрізняється від попереднього тільки константою Km, яка має більше значення, ніж константа KS, оскільки вона дозволяє певною мірою враховувати вплив кінцевого продукту реакції.
Співвідношення  називається константою Міхаеліса.
називається константою Міхаеліса.
Константа Міхаеліса відповідає концентрації субстрату, при якій швидкість ферментативної реакції дорівнює половині її максимальної швидкості.
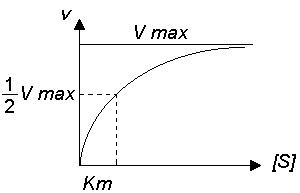
Рис.1. Залежність швидкості реакції від концентрації субстрату
Оброблюючи рівняння Міхаеліса-Ментена методом подвійних зворотних величин можна отримати рівняння прямої лінії типу у=ах+b, а саме:
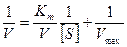 .
.
Це рівняння є лінеаризацією залежності Міхаеліса-Ментена та називається рівнянням Лайнуівера-Берка.
Читайте також:
- АВТОМАТИЗАЦІЯ РЕАКЦІЙНОГО ВУЗЛА
- Будова та реакційна здатність
- Визначення опорних реакцій трьохшарнірної арки
- Визначення реакцій балки
- Визначення реакцій в’язей
- Викривлення реакцій горя
- Вимоги до аналітичних реакцій
- Для гетерогенних реакцій швидкіть прямопропорційна площі поверхні реагуючих речовин.
- Елементи кінетики ланцюгових реакцій
- Ембріологія ока. Вікові особливості зорових рефлекторних реакцій
- ЕНЕРГЕТИКА І КІНЕТИКА РЕАКЦІЙ.
- Завдання фізичної хімії – чітке формулювання загальних законів протікання хімічних реакцій та описання їх математичними рівняннями.
| <== попередня сторінка | | | наступна сторінка ==> |
| Властивості ферментів | | | Номенклатура і класифікація ферментів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |