
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Число найближчих сусідніх частинок, які щільно приєднуються до даної частинки в кристалі або в окремій молекулі, називається координаційним числом.
Типи кристалічних решіток і властивості речовин.
Тверді речовини, як правило, мають кристалічну будову. Вона характеризується правильним розміщенням частинок у чітко визначених точках простору. При уявному з'єднанні цих точок прямими лініями, що перетинаються, утворюється просторовий каркас, який називають кристалічною решіткою. Точки, в яких розміщені частинки, називаються вузлами кристалічної решітки. У вузлах уявної решітки можуть розміщуватись іони, атоми або молекули. Вони здійснюють коливальний рух. З підвищенням температури амплітуда коливань збільшується, що виявляється в тепловому розширенні тіл.
Залежно від виду частинок і характеру зв'язку між ними і розрізняють чотири типи кристалічних решіток: іонні, атомні, молекулярні й металічні.
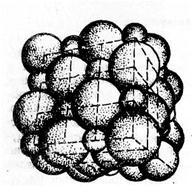
Кристалічні решітки, що складаються з іонів, називаються іонними. їх утворюють речовини з іонними зв'язками. Прикладом може бути кристал хлориду натрію, в якому, як уже зазначалося, кожен іон натрію оточений шістьма хлорид-іонами, а кожен хлорид-іон — шістьма іонами натрію. Такому розміщенню відповідає найщільніша упаковка, якщо іони уявити у вигляді куль, розміщених у кристалі (рис. 3.2.1). Дуже часто кристалічні решітки зображують так, як показано на рис. 3.2.2, де зазначено лише взаємне розміщення частинок, але не їх розміри.
У решітці хлориду натрію координаційні числа обох іонів дорівнюють 6. Отже, в кристалі хлориду натрію неможливо виділити окремі молекули солі. їх немає. Весь кристал слід розглядати як гігантську макромолекулу, що складається з однакового числа іонів Na і СІ , NanCln, де n — велике число (див. рис. 3.2.1). Зв'язки між іонами у такому кристалі досить міцні. Тому речовини з іонною решіткою мають порівняно високу твердість. Вони тугоплавкі й малолеткі.
 Плавлення іонних кристалів спричиняє до порушення геометрично правильної орієнтації іонів один відносно одного і зменшення міцності зв'язку між ними. Тому їх розплави проводять електричний струм. Іонні сполуки, як правило, легко розчиняються в рідинах, що складаються з полярних молекул, наприклад у воді.
Плавлення іонних кристалів спричиняє до порушення геометрично правильної орієнтації іонів один відносно одного і зменшення міцності зв'язку між ними. Тому їх розплави проводять електричний струм. Іонні сполуки, як правило, легко розчиняються в рідинах, що складаються з полярних молекул, наприклад у воді.
Рис. 3.2.1. Просторове розміщення Рис. 3.2.2. Кристалічна решітка
іонів о іонній решітці NaCI (дрібні NaCl
кульки — іони натрію)
Кристалічні решітки, у вузлах яких розміщуються окремі атоми, називаються атомними.Атоми в таких решітках сполучені між собою міцними ковалентними зв'язками. Прикладом може бути алмаз — одна з модифікацій карбону. Алмаз складається з атомів карбону, кожен з яких зв'язаний з чотирма сусідніми атомами. Координаційне число карбону в алмазі — 4. У решітці алмазу, як і в решітці хлориду натрію, молекул немає. Весь кристал слід розглядати як гігантську молекулу. В неорганічній хімії відома значна кількість речовин з атомною кристалічною решіткою. Вони мають високі температури плавлення (для алмазу понад 500°С), міцні й тверді, практично не розчинні у рідинах. Атомна кристалічна решітка характерна для твердого бору, кремнію, германію і сполук деяких елементів з карбоном та силіцієм.
Кристалічні решітки, що складаються з молекул (полярних і неполярних), називаються молекулярними. Молекули в таких решітках з'єднані між собою порівняно слабкими міжмолекулярними силами. Тому речовини з молекулярною решіткою мають малу твердість і низькі температури плавлення, нерозчинні або малорозчинні у воді, їх розчини майже не проводять електричного струму. Число неорганічних речовин з молекулярною решіткою незначне. Прикладами їх є лід, твердий оксид карбону(ІV) ("сухий лід"), тверді галогеноводні, тверді прості речовини, утворені одно- (благородні гази), двох- (F2, Сl2, Вr2, І2, Н2, ,O2, N2),
 |  | ||
Рис. 3.2.3. Кристалічна решітка йоду Рис. 3.2.4. Схематичне зображення
металічної решітки
трьох-(О3), чотирьох-(Р4), восьми-(S8) атомними молекулами. Молекулярна кристалічна решітка йоду подана на рис. 3.2.3. Більшість кристалічних органічних сполук мають молекулярну решітку.
У твердому стані метали утворюють металічні кристалічні решітки. Останні звичайно описують як поєднання катіонів металу, сполучених в одне ціле валентними електронами, тобто негативно зарядженим "електронним газом". Електрони електростатично притягуються катіонами, що забезпечує стабільність решітки. На рис. 3.2.4 подано схематичне зображення металічної решітки (вільні електрони зображені точками). Порівняйте її з іншими типами кристалічних решіток.
Читайте також:
- Алгоритм знаходження ДДНФ (ДКНФ) для даної булевої функції
- Але відмінні від значення функції в точці або значення не існує, то точка називається точкою усувного розриву функції .
- Аморфний та кристалічний стан твердої речовини.
- Атомно-кристалічна структура металів
- Безрозмірною характеристикою гідротрансформатора називається залежність коефіцієнтів пропорційності моментів насосного і турбінного коліс від його передаточного відношення.
- Біоценоз – це сукупність усіх живих організмів в рамках даної екосистеми.
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
- Вартість грошей Число обертів грошової одиниці
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Визначення. Точка О називається полюсом, а промінь l – полярною віссю.
- Визначення. Якщо кожному натуральному числу n поставлено у відповідність число хn, то говорять, що задано послідовність
- Визначення: Площина, що проходить через дотичну й головну нормаль до кривої в точці А називається дотичною площиною.
| <== попередня сторінка | | | наступна сторінка ==> |
| Стереохімія звичних циклів. | | | Внутрішня будова твердої речовини |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |