
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ЗАВДАННЯ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗАННЯ
1. Яка кількість молекул міститься в 1 см3 повітря за нормальних умов (н.у.)?
2. За н. у. маса 0,18 дм3 газу дорівнює 0.36 г. Обчисліть молярну масу і масу однієї молекули цього газу.
3. Молекула речовини має масу 1.66´10–25 кг. Чому дорівнює молярна маса речовини?
4. Який об'єм за н.у. займають 2.69´1022 молекул газу?
5. Обчисліть масу кисню, яка потрібна для згоряння 10 л метану (н.у.).
6. Який об'єм вуглекислого газу утворюється під час згоряння 1 м3 етану?
7. Який об'єм кисню ( Р=110 кПа; Т=294 К ) потрібний для повного згоряння 100 г алюмінієвого порошку?
8. Карбід кальцію масою 10 г розчинили у воді. Який об'єм газу виділиться за н.у.?
9. Визначити, який об'єм займатимуть 36 г пари води при 398 К і 100 кПа.
10. Маса 0,25 м3 газу дорівнює 189,8 г за н.у. Визначте масу однієї молекули газу.
11. Визначити, ізотоп якого елемента (Е) утворюється при ядерних перетвореннях:
а) N14+a ® p + E ;
б) Al27 + N14. ®.a + E , в) P31 + n ® p + E.
12. Мідь у природі зустрічається у вигляді ізотопів з масовими числами 63 і 65, вміст яких становить 73 і 27 % відповідно. Обчисліть середню атомну масу міді.
13. Хлор в природі зустрічається у вигляді ізотопів з масовими числами 35 і 37. Встановіть вміст кожного ізотопу, якщо відомо, що атомна маса хлору становить 35, 45.
14. Складіть електронну формулу технецію. Який сумарний спін мають всі його електрони.
15. Визначити максимально можливу кількість електронів на p-, d-, f- орбіталях.
16. Атомомі якого елемента відповідає електронна формула 1s22s22p63s23p64s23d8. Яку кількість неспарених електронів має цей елемент?
17. Яку кількість протонів і нейтронів містить ядро атома фтору? Запишіть його електронну формулу.
18. Складіть електронну і електронно-графічну формули атома елемента (Е), що утворюється за ядерною реакцією 29Cu63 + p = E + n
19. Складіть електронну формулу елемента з порядковим номером 55. До якого електронного сімейства належить цей елемент?
20. Визначте максимально можливу кількість електронів на 3, 4, 5 електронних рівнях.
21. У якого з перерахованих пар елементів менша енергія іонізації: а) Be— Mg; б) K — Ca; в) H — He?
22. У якого з перерахованих пар елементів більша спорідненість до електрону: а) N — F; б) О — S; в) Br — Kr?
23. У якого з перерахованих пар елементів більша електронегативність: а) Мg — Si; б) Be — Sr; в) F — I?
24. Дані елементи: Sn, Li, Rb, Cs. Розташуйте їх у послідовності зростання металічних властивостей.
25. Як змінюються радіуси атомів у групах і періодах періодичної системи елементів?
26. Який з елементів періодичної системи більш виявляє: а) металічні, б) неметалічні властивості?
27. Що таке електронні аналоги? Чи належать Mg і Cl до електронних аналогів?
28. Який взаємозв’язок між електронною структурою атомів та їх положенням у періодичній системі?
29. Розташуйте такі елементи у порядку зростання металічних властивостей: Bi, Cs, Tl, Fr, Na.
30. Розташуйте такі елементи у порядку зростання неметалічних властивостей: Cl, P, I, Si, Ar, F.
31. Вказати тип хімічного зв'язку в таких сполуках: N2, LiF, CO, H2O, NO, H2.
32. Розташуйте такі молекули у порядку зростання міцності хімічного зв'язку: F2, N2, O2.
33. Чим відрізняються "сігма" і "пі" типи хімічного зв'язку? Скільки таких зв'язків існує в молекулі N2?
34. Яким є просторове розташування електронних хмар відносно центрального атома при sp, sp2, sp3 - гібридизації.
35. Який хімічний зв'язок називається водневим? В яких випадках він утворюється?
36. Який хімічний зв'язок здійснюється в металах? В чому особливість цього типу зв'язку?
37. Вказати тип хімічного зв'язку в таких сполуках: CO2, P2O5, O2, NaCl, Cl2, CaO, HF.
38. Назвіть молекулу, в якій частка іонного зв'язку є: а) найменшою, б) найбільшою: LiCl, CsF, NaCL, KCl, LiI.
39. Що таке алотропія? Наведіть приклади алотропних модифікацій вуглецю та кисню.
40. Які тіла називаються кристалічними та аморфними? Яка різниця в їх будові?
41. Обчисліть тепловий ефект реакції горіння ацетилену за стандартних умов (ст. у.).
42. Чому дорівнює теплота згоряння водню: а) у кисні, б) у фторі?
43. У чому полягає відмінність фазових перетворень від хімічних процесів? Обчисліть зміну ентальпії при таких фазових перетвореннях: а) H2O(p) = H2O(г), б) H2O(т) = H2O(р)..
44. В ракетних двигунах в якості палива використовують гідразин (N2H4), а в якості окислювача N2O4. При їх взаємодії відбувається реакція
2N2H4(Р)+N2O4(Р)=3N2(Г)+4Н2О(Г); 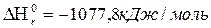
Яка кількість тепла виділиться при згорянні 1 кг гідразину?
45. Визначити теплотворну здатність оксиду вуглецю (II), якщо теплота згоряння СО складає –283 кДж/моль.
46. Визначити теплотворну здатність газоподібного палива, якщо теплота його згоряння складає –563 кДж/моль.
47. Визначити тепловий ефект реакції відновлення оксиду заліза (II) воднем виходячи з таких термохімічних рівнянь:
FeO(K)+CO(Г)= Fe(K)+CO2(Г); 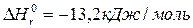
CO(Г)+0,5O2(Г)= CO2(Г); 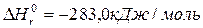
H2(Г)+O2(Г)=H2O(Г); 
48. Визначити теплоту утворення фосфіну (РН3), виходячи з термохімічного рівняння:
2РН3(Г)+4О2(Г)= Р2О5(K)+3Н2О(Р); 
49. Спирти можна використовувати як палива. Який спирт метанол чи етанол є енергетично більш ефективним?
50. Яка кількість тепла вилучиться під час згоряння 1м3 (н.у.) етилену?
51. Визначить, чи можливе самочинне розкладання бертолетової солі за реакцією 2KClO3(т) = 2KCI(т) + 3O2 за ст. у.?
52. Чи можливий самочинний перебіг реакції N2 + O2 = 2NO в ізольованій системі?
53. Чи можливий самочинний перебіг реакції CO + 0,5O2 = CO2 в замкненій системі за ст.у.?
54. Не виконуючи розрахунків, встановити знак DS таких процесів:
а) 2NH3(Г)=N2(Г) + 3H2(Г); б) Н2О(Р)= Н2О(К)
54. Не виконуючи розрахунків, встановити знак DS таких процесів:
а) 2NO(Г)+ O2(Г)=2NO2(Г)
б) 2H2S(Г)+3O2(Г)=2H2O(P)+2SO2(P)
55. Визначити можливість відновлення оксиду заліза (II) воднем в замкненій системі за стандартних умов.
56. Визначити можливість самочинного протікання процесу:
2H2S(Г)+3O2(Г)=2H2O(P)+2SO2(P)
в замкненій системі за стандартних умов.
57. Визначити можливість самочинного протікання процесу:
FeO(K)+CO(Г)= Fe(K)+CO2(Г);
в замкненій системі за стандартних умов.
58. Визначити зміну енергії Гібсса реакції:
2NO(Г)+ O2(Г)=2NO2(Г)
Зробити висновок про можливість протікання такої реакції.
59. Визначити зміну енергії Гібсса реакції:
2NH3(Г)=N2(Г) + 3H2(Г)
Зробити висновок про можливість протікання такої реакції.
60. Визначить, чи можливе самочинне розкладання перманганату калію за реакцією:
2KMnO4(T) = K2MnO4(T) + MnO2(T) + O2(Г)
за стандартних умов?
61. Як зміниться швидкість реакції 2H2 + O2 = 2H2O, якщо концентрацію водню збільшити у два рази, а концентрацію кисню зменшити у три рази?
62. Як зміниться швидкість реакції N2 + 3H2 = 2NH3, яка перебігає в замкненому просторі, якщо об'єм системи зменшити в 3 рази?
63. Як зміниться швидкість реакції H2 + Cl2 = 2HCl, якщо концентрацію водню збільшити в 3 рази, а концентрацію кисню зменшити удвічі?
64. Реакція відбувається за рівнянням:
2NO + O2 = 2NO2
Концентрації реагуючих речовин були С(NO)=0,8 моль/л; С(O2)=0,6 моль/л. Як зміниться швидкість реакції, якщо концентрацію кисню збільшити до 0,9, а концентрацію оксиду азоту до 1,2 моль/л.
65. Знайти значення константи швидкості реакції:
H2 + F2 = 2 HF,
якщо при концентраціях H2 і F2 рівних відповідно 0,5 і 0,1 моль/л, швидкість реакції складає 0,005 моль/(л×с).
66. В замкненому об'ємі відбувається реакція N2 + 2O2 = 2NO2. За 3 хвилини концентрація NO зменшилась з 1,2 до 0,6 моль/л. Визначте середню швидкість реакції?
67. Реакція відбувається за рівнянням: СO + Сl2 = COCl2
Концентрації СO і Сl2 складають 0,5 моль/л; 0,3 моль/л відповідно. Константа швидкості реакції дорівнює 0,8 л/(моль×с). Визначити швидкість реакції.
68. Як зміниться швидкість реакції утворення N2O:
2N2 + O2 = 2N2O,
якщо тиск в системі збільшити в 3 рази?
69. Як змініться швидкість прямої і оборотної реакції:
4 HCl + O2 = 2 H2O + 2 Cl2,
якщо об’єм газової суміші зменшити в два рази?
70. Як зміниться швидкість гетерогенної реакції:
FeO(T) + H2(Г) ® Fe(Т) + H2O(Г) ,
якщо тиск газу підвищити в з рази?
71. Як зміниться швидкість реакції, якщо температуру підвищити з 0 до 50 градусів за Цельсієм? Температурний коефіцієнт швидкості реакції дорівнює 3.
72. При підвищенні температури на 20 К швидкість реакції зростає у 9 разів. Як зміниться швидкість цієї реакції, якщо температуру підвищити на 30 К?
73. Як зміниться швидкість реакції 2SO2 + O2 = 2SO3, яка перебігає в замкненому просторі, якщо об'єм системи зменшити в 3 рази, а температуру підвищити на 20 К? Температурний коефіцієнт швидкості дорівнює 2.
74. При підвищенні температури від 300 К до 400 К швидкість реакції зросла в 1000 разів. Визначте енергію активації цієї реакції.
75. Як зросте швидкість реакції при підвищенні температури з 400 до 450 К, якщо відомо, що енергія активації цієї реакції дорівнює 30 кДж/моль?
76. Введення каталізатора при Т=300 К підвищило швидкість реакції в 100 разів. Як каталізатор змінив енергію активації?
77. Як треба змінити температуру, щоб швидкість хімічної реакції зросла в 91 раз? Температурний коефіцієнт швидкості реакції дорівнює 3.
78. Температурний коефіцієнт швидкості реакції розкладення йодистого водню:
2 НІ = Н2 + І2,
дорівнює 2. Визначити константу швидкості цієї реакції при 700 К, якщо при 650 К константа швидкості дорівнює 8,9×10-5.
79. Визначити енергію активації реакції, якщо при збільшенні температури з 273 К до 298 К швидкість реакції збільшується в 5 разів.
80. Енергія активації реакції:
2 НІ = Н2 + І2,
дорівнює 186,4 кДж/моль. Визначити константу швидкості цієї реакції при 700 К, якщо при 500 К вона дорівнює 0,89×10-6.
81. У замкненій посудині об'ємом 2 дм3 змішали 0,2 моль водню та 0,15 моль хлору. До моменту встановлення рівноваги прореагувало 50 % водню. Обчисліть константу рівноваги.
82. Рівновага в системі 2SO2 + O2 = 2SO3 досягнута при концентраціях [SO2]=1моль/л; [O2] = 2 моль/л; [SO3] = 2 моль/л. Обчисліть константу рівноваги і вихідні концентрації диоксиду сірки та кисню.
83. Реакція перебігає за рівнянням H2+Cl2 = 2HCl. Вихідні концентрації H2 і Сl2 становлять 2,0 і 1,0 моль/л відповідно. Якою буде концентрація HCl в стані рівноваги, якщо К = 2.
84. В якому напрямку зміститься рівновага в системі N2 + 3H2= = 2NH3+ Q, якщо: а) підвищити температуру, б) збільшити тиск?
85. Чому зміна тиску не зміщує рівновагу в системі N2 + O2= =2NO і зміщує для системи 2NO + O2 = 2NO2 ?
86. В яких випадках не впливає на положення рівноваги:
а) зміна температури, б) зміна тиску?
87. Виходячи з термодинамічних даних, обчисліть константу рівноваги реакції N2 + 3H2 = 2NH3 за ст.у.?
88. Константа рівноваги реакції H2 + I2(г) = 2HI(г) при Т=800 К дорівнює 0,16. Обчисліть зміну енергії Гіббса цієї реакції.
89. Виходячи з термодинамічних даних, обчисліть константу рівноваги реакції СO2 + H2 = CO + H2O за (ст. ум).
90. Константа рівноваги реакції FeO(т)+СO(г) = Fe(т) + CO2(г) при Т=1000 К дорівнює 10. Яка кількість СО залишиться при досягненні стану рівноваги, якщо початкові концентрації оксиду і диоксиду вуглецю складали 1,8 і 0,8 моль/л відповідно?
91. Обчисліть молярну концентрацію хлориду алюмінію з масовою часткою солі 16 %. Густина розчину 1,15 кг/л.
92. Обчислити рН розчину, що утворився при розчиненні 1 г натрію в 1 л води. Густину розчину прийняти 1,00 кг/л.
93. Який об'єм розчину НCl з масовою часткою кислоти 20 % і густиною 1,10 г/см3 потрібний для виготовлення 1 л розчину з масовою часткою 10 % і густиною 1,05 г/см3?
94. Розчин, що містить 3,0 г неелектроліту в 150 г води, кристалізується при t = –1,20С . Визначте молярну масу розчиненої речовини. Кріоскопічна стала води дорівнює 1,86.
95. Визначте температуру кипіння 15 % розчину хлориду натрію. Відомо, що ізотонічний коефіцієнт розчину дорівнює 1,9 , ебуліоскопічна стала води 0,52.
96. Чому дорівнює осмотичний тиск розчину глюкози з концентрацією 0,1 моль/л при Т=300 К?
97. Що таке піни? Як вони утворюються? Що впливає на стійкість пін?
98. Що таке кратність пін? Як отримують піни? Де вони застосовуються?
99. Розрахуйте концентрацію іонів водню у розчині оцтової кислоти з молярною концентрацією 0,01моль/л.( KCH3COOH = 1,7x10-5)
100. Чи випаде осад при зливанні однакових об'ємів 0,01 М розчинів SrCl2 і K2SO4? ( ДР(SrSO4) = 3,2×10–7).
101. Розчинність карбонату кальцію в воді складає 5×10-5 моль/л. Визначити добуток розчинності цієї солі.
102. Визначити рН розчину, в 1 л якого міститься 0,1 г NaOH.
103. Визначити рН розчину, в 1 л якого міститься 0,5 г Н2SO4.
104. Розрахувати добуток розчинності броміду свинцю (II), якщо розчинність цієї солі дорівнює 1,3×10–2моль/л.
105. Розчин хлориду натрію починає кристалізуватися при –0,8оС. При якій температурі починається кипіння цього розчину? Кріоскопічна та ебуліоскопічна сталі води відповідно дорівнюють 1,86 і 0,52 К×кг/моль.
106. Визначити константу дисоціації одноосновної кислоти, якщо відомо, що її розчин з концентрацією 0,08 моль/л має рН=2,4.
107. Чому дорівнює осмотичний тиск розчину карбаміду (СО(NH2)2) з концентрацією 0,5 моль/л при Т=320 К?
108. Розчин, що вміщує 16,05 г нітрату барію в 500 г води, кипить при 100,122оС. Визначити ізотонічний коефіцієнт цього розчину.
109. Розчин, що вміщує 2,1 г КОН в 250 г води, починає кристалізуватися при –0,519оС. Визначити ізотонічний коефіцієнт цього розчину. Кріоскопічна стала води дорівнює 1,86.
110. Яка різниця між колоїдними та істинними розчинами? Яку будову мають міцели?
111-120. Складіть молекулярні та іонні рівняння реакцій, що відбуваються в розчині, між такими речовинами (а), а також молекулярні та іонні рівняння реакцій гідролізу солей (б):
| Номер завдання | а | б |
| Pb(NO3)2 i NaOH | Na2CO3 | |
| Pb(NO3)2 i H2SO4 | K2SiO3 | |
| K2CO3 і BaCl2 | SnCl2 | |
| AgNO3 i NaCl | CH3COONa | |
| FeCl2 i NaOH | NaNO2 | |
| K2SiO3 i HCl | NH4Cl | |
| K2S i HBr | Na2SiO3 | |
| CH3COOH i NaOH | CuCl2 | |
| NH4OH i HCl | FeCl3 | |
| Na2S і HCl | K2CO3 |
121-130. На підставі електронних рівнянь підберіть коефіцієнти в рівняннях реакцій. Визначте, яка речовина є окислювачем, а яка відновлювачем?
121. H2S + Cl2 + H2O ® H2SO4 + HCl.
122. KBr + KBrO3 + H2SO4 ® Br2 + K2SO4 + H2O.
123. KMnO4+Na2SO3+H2SO4 ® MnSO4 +Na2SO4+K2SO4+H2O.
124. NaCrO2 + PbO2 + NaOH ® Na2CrO4 + Na2PbO2 + H2O.
125. KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O.
126. Na2C2O4+KBrO3+H2O ®CO2+KBr+NaOH
127.VSO4+K2CrO7+H2SO4®V2(SO4)3+Cr2(SO4)3+K2SO4+H2O
128. H2S+K2CrO7+H2SO4®S+Cr2(SO4)3+K2SO4+H2O
129. P+HNO3+ H2O®H3PO4+NO
130. Cr2O3+KClO3+KOH®K2CrO7+KCl+H2O
131-140. Визначте ЕРС гальванічного елементу. Запишіть рівняння реакцій, що відбуваються під час роботи гальванічного елементу.
131. Zn½ ZnSO4 ( C=1,0M)½½ AgNO3 (C=0,1M) ½ Ag
132. Pt(H2)½ HCl(C=0,1M) ½½ CuSO4 (C=0,01M) ½Cu
133. Mg½ MgCl2 (C=10–3M) ½½ Zn(NO3)2 (C=10–4M)½Zn
134. Pt(H2)½ H2SO4(C=0,05M)½½AgNO3 (C=0,01M) ½ Ag
135. Cu½ CuSO4 (C=1M) ½½ CuSO4 (C=0,01M) ½Cu
136. Fe½ FeSO4 ( C=1,0M)½½ AgNO3 (C=0,1M) ½ Ag
137. Pt(H2)½ HCl(C=0,1M) ½½ NiSO4 (C=0,01M) ½Ni
138. Al½ AlCl3 (C=10–3M) ½½ Zn(NO3)2 (C=10–4M)½Zn
139. Pt(H2)½ H2SO4(C=0,05M)½½Hg(NO3)2(C=0,01M) ½ Hg
140. Ni½ NiSO4 (C=1M) ½½ CuSO4 (C=0,01M) ½Cu
141. При електролізі розчину мідного купоросу за 2 години на катоді вилучилось 2,24 г міді. Чому дорівнює сила струму? Запишіть катодні та анодні процеси?
142. Електричний струм силою 5 А проходить крізь розчин сірчаної кислоти. Розрахувати об'єми газів (н.у.), які вилучаться на електродах за 1 годину.
143. Які продукти утворюються при електролізі водного розчину сульфату заліза? Запишіть рівняння реакцій, що відбуваються на графітових електродах.
144. Складіть схеми електролізу водного розчину хлориду цинку, якщо анод: а) цинковий, б) вугільний.
145. При електролізі розчину нітрату срібла на катоді вилучилось 10 г срібла. Яка кількість електрики пропущена крізь розчин?
146. При електролізі розчину AgNO3 за 2 години на катоді вилучилось 5 г срібла. Чому дорівнює сила струму? Запишіть катодні та анодні процеси?
147. Електричний струм силою 3 А проходить крізь розчин соляної кислоти. Розрахувати об'єми газів (н.у.), які вилучаться на електродах за 1 годину.
148. Які продукти утворюються при електролізі водного розчину сульфату нікелю? Запишіть рівняння реакцій, що відбуваються на графітових електродах.
149. Складіть схеми електролізу водного розчину хлориду кадмію, якщо анод: а) кадмієвий, б) вугільний.
150. При електролізі розчину нітрату міді на катоді вилучилось 10 г міді. Яка кількість електрики пропущена крізь розчин?
151. Чи має захисні властивості оксидна плівка на поверхні натрію? Густина натрію та його оксиду складають 970 і 2270 кг/м3 відповідно.
152. Чи має захисні властивості оксидна плівка на поверхні кальцію? Густина кальцію та його оксиду складають 1540 і 3400 кг/м3 відповідно.
153. Чи має захисні властивості оксидна плівка на поверхні магнію? Густина магнію та його оксиду складають 1740 і 3580 кг/м3 відповідно.
154. Чи має захисні властивості оксидна плівка (FeO) на поверхні заліза? Густина заліза та його оксиду складають 7874 і 5700 кг/м3 відповідно.
155. Чи має захисні властивості оксидна плівка на поверхні нікелю? Густина нікелю та його оксиду складають 970 і 2270 кг/м3 відповідно.
156. Як відбувається корозія заліза під час контакту з нікелем: а) в нейтральному, б) у кислому розчинах? Складіть схему гальванопари, а також запишіть рівняння процесів, що відбуваються на катоді та аноді.
157. Як відбувається корозія алюмінію під час контакту з нікелем: а) в нейтральному, б) у кислому розчинах? Складіть схему гальванопари, а також запишіть рівняння процесів, що відбуваються на катоді та аноді.
158. Як відбувається корозія магнію під час контакту з свинцем: а) в нейтральному, б) у кислому розчинах? Складіть схему гальванопари, а також запишіть рівняння процесів, що відбуваються на катоді та аноді.
159. Як відбувається корозія цинку під час контакту з міддю: а) в нейтральному, б) у кислому розчинах? Складіть схему гальванопари, а також запишіть рівняння процесів, що відбуваються на катоді та аноді.
160. Як відбувається корозія міді під час контакту з нікелем: а) в нейтральному, б) у кислому розчинах? Складіть схему гальванопари, а також запишіть рівняння процесів, що відбуваються на катоді та аноді.
161-170. Запишить рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
161. Ca®Ca(OH)2®CaCO3®CaCl2®CaSO4.
162. Fe®FeCl2®Fe(OH)2®Fe(OH)3®Fe2(SO4)3®Fe.
163. Cu®Cu(NO3)2®Cu(OH)2®CuCl2®Cu(NO3)2.
164. Na®Na2O2®NaOH®NaCl®NaNO3.
165. Al® Al2(SO4)3® Al(OH)3®Na[Al(OH)4]® AlCl3.
166. K®KO2®KOH®КBr®KNO3
167. Li®LiH®LiOH®LiCl®LiNO3
168. Ca®CaH2®Ca(OH)2®CaCO3®CaCl2
169. Mg®MgCl2®Mg(OH)2®Mg3(PO4)2
170. Cr®CrCl3®Cr(OH)3®Cr(NO3)3®Cr
171. Під час взаємодії 1 г заліза з киснем утворилось 1,43 г оксиду. Встановіть формулу цього оксиду.
172. Який об'єм газу (н.у.) виділиться під час взаємодії 1 г калію з надлишком води?
173. Які прості речовини самозаймаються під час дії на них: а) повітря, б) води? Складіть рівняння відповідних реакцій.
174. Суміш масою 0,85 г складається з гідридів літію і кальцію. Після взаємодії цієї суміші з надлишком води виділилось 1,2 л водню за н.у. Визначити кількісний склад суміші.
175. Залізну пластинку масою 100 г занурили в розчин сульфату міді (ІІ). Розрахувати масу заліза, яка перейшла в розчин, якщо відомо, що маса пластинки збільшилась на 3 г.
176. Скільки хлороводню можна добути з 5 г водню і 10 г хлору?
177. Який об'єм кисню (н.у.) потрібний для повного спалювання 30 г сірки?
178. Рівняння реакції горіння чорного пороху має вигляд:
2KNO3 + S + 3C ® N2 + 3CO2 + K2S.
Обчисліть кількість тепла, що виділяється під час згоряння 1 кг чорного пороху.
179. Скільки тепла виділиться під час згоряння 1 м3 аміаку за н.у.?
180. Яке з азотних добрив, нітрат амонію чи сечовина, містить більше азоту?
181-190. Запишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
181. S®SO2®SO3®H2SO4®SO2 .
182. N2®NH3®NO®NO2®HNO3.
183. C®CO®CO2®CaCO3®CO2.
184. Сl2®HCl®Сl2®FeCl3®AgCl.
185. Si®SiCl4®SiO2®Na2SiO3®CaSiO3.
186. Н2®КН®Н2®Н2О® Н2.
187. Р®Р2О5®Н3РО4®NaH2РО4.
188. I2®HI®I2®CaI2®AgI
189. N2®NO®NO2®HNO3®NO.
190. C® CO2®Na2CO3® CO2® CO.
191. Після озонування при сталій температурі об'єм кисню зменшився на 500 мл. Який об'єм озону утворився?
192. Суміші хлорату калію(КСlО3) з горючими речовинами здатні вибухати від удару: КСlО3+S®KCl+SO2. Cкількі грамів КСlО3 повинно прореагувати, щоб утворився 1 м3 SO2 (н.y.)?
193. Скільки вуглекислого газу можна одержати з 10 л 5 % розчину NaHCO3. Густина розчину складає 1050 кг/м3.
194. Скільки оксиду фосфору (V) утворюється при повному згорянні 100 г фосфору?
195. При детонації нітрат амонію розкладається згідно з рівнянням:
2NH4NO3(КР)®2N2(Г)+4H2O(Г)+O2(Г).
Визначити об'єм газів (н.у.) що утвориться при розкладанні 1 кг нітрату амонію.
196. Яку кількість оксиду міді (II) можна відновити за допомогою 10 л водню за нормальних умов?
197. Під час прожарювання 1 кг вапняку (СаСО3) вилучилось 200 л вуглекислого газу. Визначити процентний вміст некарбонатних домішок в вапняку.
198. Яку кількість силікагелю можна отримати з 1 кг 10 % розчину силікату натрію?
199. Який об'єм газу (н.у.) утвориться при розчиненні 2,3 г натрію в воді?
200. Який об'єм газу (н.у.) утвориться при розчиненні 10 г гідриду кальцію в воді?
201. Зобразити структурні формули ізомерів алкану C6H14 і назвати їх.
202. Напишіть структурну формулу 2,4,5,5-тетраметил-3-етилоктану. Зазначте всі первинні, вторинні, третинні та четвертинні вуглецеві атоми.
203. Скільки ізомерних дихлорпохідних може бути в н-бутані? Напишіть структурні формули цих похідних та назвіть їх.
204. Органічна речовина містить вуглець (масова частка 84,12%) та водень (15,79%). Густина пари речовини за повітрям складає 3,93. Визначте формулу речовини.
205. Алкан має густину пари за повітрям 4,414. Визначте формулу алкану.
206. Для згоряння деякого алкану потрібний об'єм кисню у 8 разів більший, ніж об'єм пари цього вуглеводню за таких самих умов. Визначте формулу алкану.
207. Яку масу бромної води з масовою часткою брому 1,6 % в може знебарвити пропілен об'ємом 1,12 л (н.у.)?
208. Складіть структурні формули ізомерів, що відповідають формулі C8H10 і містять ароматичне кільце. Дайте їх назву.
209. Який об'єм повітря потрібний для спалювання газу, що містить 80% (за об'ємом) метану і 20 % етану? Об'ємна частка кисню в повітрі 21%.
210. Які речовини утворюються під час спалювання органічних сполук? Які органічні сполуки не здатні до горіння?
211. Напишіть структурні формули спиртів складу C4H9OH та назвіть їх.
212. Яку масу пропілату натрію можна добути під час взаємодії пропанолу масою 15 г з натрієм масою 9,2 г?
213. Під час взаємодії розчину фенолу у бензолі масою 200 г з надлишком бромної води добули бромпохідну сполуку масою 66,2 г. Визначте масову частку фенолу у розчині.
214. Напишіть структурні формули таких речовин: 2,3 - диметил- бутаналь, 2,3 - диметилгептанова кислота, 2 - метил-3 етилпентанол-1. До якого з класів органічних сполук відноситься кожна речовина.
215. Під час взаємодії етанолу масою 13,8 г з оксидом міді (ІІ) масою 28 г добули альдегід, маса якого становила 9,24 г. Визначте вихід продукту реакції.
216. У трьох пробірках без написів знаходяться такі речовини: етанол, мурашина кислота, оцтова кислота. За допомогою яких хімічних методів можна розпізнати ці речовини?
217. Яку масу оцтової кислоти можна здобути з 20 г карбіду кальцію?
218. На нейтралізацію 200 г розчину оцтової кислоти у воді витратили 40 г розчину з масовою часткою гідроксиду натрію 10 %. Визначте масову частку кислоти в розчині.
219. Яку масу етилацетату можна добути у реакції етерифікації етанолу масою 1,61 г і оцтової кислоти масою 1,80 г, якщо вихід продуктів реакції дорівнює 75 %?
220. Під час нагрівання метанолу масою 2,4 г і оцтової кислоти масою 3,6 г добули метилацетат масою 3,7 г. Визначте вихід ефіру.
221. Який об'єм вуглекислого газу (н.у.) виділиться під час спиртового бродіння глюкози масою 270 г?
222. Який об'єм повітря (н.у.) потрібний для повного окислення глюкози масою 45 г?
223. За світловий день листок буряка площею 1 дм2 може поглинути 44,8 мл вуглекислого газу (н.у.). Яка маса сахарози утвориться при цьому в результаті фотосинтезу?
224. Яку масу триацетату целюлози можна добути з деревини масою 1,62 т, якщо ефір добувають з виходом 75%? Масова частка целюлози в деревині становить 50%.
225. Скільки ізомерних амінів може відповідати формулі C3H9N? Напишіть структурні формули і дайте назву всіх ізомерів.
226. Який об'єм азоту (н.у.) утвориться при згорянні етиламіну масою 5,4 г?
227. При відновленні нітробензолу масою 73,8 г добули анілін масою 48,0 г. Визначте вихід продукту.
228. Яка кількість тепла виділиться під час вибуху 1кг нітрогліцерину? Відомо, що теплота утворення тринітрогліцерину дорівнює 1416 кДж/моль, а продуктами вибуху є вуглекислий газ, вода, азот і кисень.
229. Що таке тринітротолуол? Як його добувають і де використовують?
230. Яку масу стеаринової кислоти можна добути з мила, що містить стеарат натрію масою 96,6 г? Вихід кислоти становить 75%.
231-240. Для наведених органічних сполук записати структурні формули, вказати які типи гібридизації мають атоми карбону. Для кожної речовини вказати до якого класу органічних сполук вона відноситься та записати максимально можливу кількість реакцій, які характеризують їх хімічні властивості:
231. 3,4 – диметилпентин –1; пропантріол –1,2,3; етилкалій.
232. 3 – етилгептан; метоксиметан; 2–нітропропан.
233. 2–метил–3–етилгептан; пентанон–3; 1,3,5 – тринітробензол.
234. 2–хлор–3–етилгептан; хлорбензол; триетиламін.
235. Пентен–2; пропанол–1; 1– нітробутан.
236. 2–метилгексан; 2–метилбутаналь; 2–метилфенол.
237. 2–метилбутан; етандіол–1,2; диметил–бутиламін.
238. 3–метилбутин–1; 3–метилбутанол–1; бутиламін.
239. 2–метилбутен–1; 2,2–диметилпропанол–1;
240. 3–метилбутен–1; 2–метилбутанол–1; етилмагній – йодид.
241–250. Записати рівняння реакцій за допомогою яких можна здійснити такі перетворення:
241. C2H6 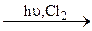 A
A 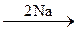 B
B 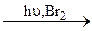 C.
C.
242. C6H5–Cl 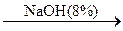 A
A 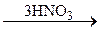 B
B  C.
C.
243. CaC2 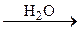 A
A 

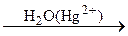 B
B 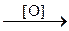 C
C 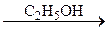 D.
D.
244. C2H5OH 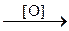 A
A 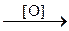 B
B 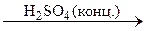 C.
C.
245. CH2 = CH2 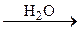 A
A 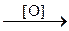 B
B 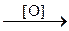 C.
C.
246. CH4 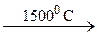 A
A 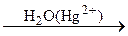 B
B 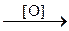 C.
C.
247. CH3CH2CH2CH3 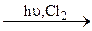 A
A 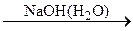 B
B 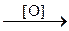 C.
C.
248. CH4 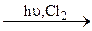 A
A 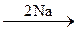 B
B 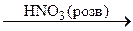 C.
C.
249. CH3 – CH = CH2  A
A 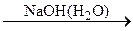 B
B 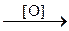 C.
C.
250. CH4 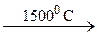 A
A 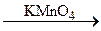 B
B 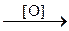 C.
C.
251. Яку масу бутадієнового каучуку можна добути з 1 кг етанолу?
252. Які процеси мають місце під час вулканізації каучуку? Чим відрізняються каучук, гума та ебоніт?
253. В чому полягає різниця між реакціями полімеризації та поліконденсації? Складіть схему поліконденсації a– амінокапронової кислоти .
254. Чому полімери бувають тільки в конденсованому стані? Які процеси відбуваються під час нагрівання термопластичних полімерів?
255. Запропонуйте схему добування полімеру, що містить елементарні ланки (–СО–NН–).
256. Назвіть основні компоненти, що входять до складу пластмас, і визначте їх призначення.
257. Що являють собою склопластики? Як впливає на механічні властивості пластмас армування їх волокнами?
258. Що таке кополімери? Наведіть приклади. Зобразіть формулу бутадієн-стирольного каучуку.
259. Запишіть рівняння повного згоряння натурального каучуку. Зобразіть його елементарну ланку.
260. Яка будова полімерів називається стереорегулярною? Як будова полімерів впливає на їх властивості?
261. До складу багатьох рідких палив не входять сполуки азоту, проте в продуктах згоряння вони виявляються. Наведіть рівняння реакцій та поясніть утворення оксидів азоту.
262. Під час горіння сірковмісних різновидів палива утворюються оксиди сірки. Наведіть відповідні рівняння реакцій. Поясніть, що таке "кислотні дощі"?
263. Назвіть речовини, що утворюються під час горіння твердого палива. Як впливає брак кисню на склад продуктів горіння?
264. Що таке "озоновий щит" Землі? Які речовини впливають на вміст озону в атмосфері?
265. Запропонуйте і обгрунтуйте методику очищення промислових стічних вод від розчинених сполук міді.
266. Запропонуйте методику очищення димових газів від диоксиду сірки. Наведіть рівняння відповідних реакцій.
267. Як очистити промислові стічні води від сполук ртуті та свинцю? Наведіть рівняння відповідних реакцій.
268. Яку роль відіграють ТЕС у виникненні "парникового ефекту"? В чому полягає його екологічна небезпека?
269. Що таке радіоактивні відходи? Як вони виникають?
270. За допомогою яких апаратів можна зменшити вміст пилу в газових викидах ТЕС і металургійних заводів?
Читайте також:
- I. Постановка завдання статистичного дослідження
- I. ПРЕДМЕТ, МЕТА ТА ЗАВДАННЯ ДИСЦИПЛІНИ
- II. Завдання на проект.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
- II. Перевірка домашнього завдання.
| <== попередня сторінка | | | наступна сторінка ==> |
| Проблема радіоактивних відходів | | | ДОДАТОК |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |