
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічна рівновага
Вивчаючи основні закономірності рівноважних процесів, перш за все необхідно розглянути поняття оборотних і необоротних реакцій, оборотність хімічних процесів.
Необоротними хімічними реакціями називаються реакції, які відбуваються тільки в одному напрямку. До таких належать, наприклад, реакції розкладу калій перманґанату під час нагрівання:
2KMnO4 = K2MnO4 + MnO2 + O2
чи взаємодія лужних металів з водою:
2K + 2H2O = 2KOH + H2.
Оборотними називаються реакції, які можуть відбуватися в прямому та зворотному напрямках. До таких реакцій належить, наприклд, взаємодія кисню з воднем:
2H2 + O2 Û 2H2O.
За температури 800 – 1500°С кисень із воднем утворюють воду, взаємодіючи дуже бурхливо. При температурі 3000 – 4000°С навпаки, вода розкладається з утворенням Н2 і О2. Взаємодія йоду з воднем
H2 + I2 Û 2HI
відбувається при температурі 300 – 400°С. За такої ж температури можлива й зворотна реакція розкладу гідроген йодиду.
Більшість хімічних реакцій оборотні. Але для одних за певних умов зворотний напрямок неможливий (взаємодія Н2 і О2), а для інших можливі як прямий, так і зворотний (взаємодія Н2 і I2). В обох наведених прикладах можна виявити зворотну реакцію і навіть визначити швидкість обох напрямків. Існують умови, за яких одночасно відбуваються пряма і зворотна реакції. Однак відомі процеси, для яких визначити швидкість зворотної реакції неможливо і тому можна тільки говорити про її оборотність. З’ясуємо, якою мірою той чи інший оборотний процес залежить від природи реагуючих речовин і умов, за яких здійснюється.
Розглянемо більш детально оборотні реакції, які одночасно за певних умовах відбуваються у двох напрямках:
aA + bB Û cC + dD.
У перший момент швидкість прямої реакції

визначається початковими концентраціями вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. У міру взаємодії А і В і утворення С і D швидкість прямої реакції зменшується, а зворотної -

зростає. Через певний час швидкості прямої і зворотної реакцій зрівняються (рис. 19). При цьому кількість утворених молекул С і D буде дорівнювати кількості молекул С i D, які прореагували й перетворились на А і B.
Стан реагуючої системи, за якого швидкості прямої та зворотної реакцій однакові, називаєтьсяхімічною рівновагою.У стані хімічної рівноваги кількість і концентрація вихідних речовин, а також продуктів їх реакції не змінюються (рівноважні), тобто хімічна рівновага має динамічний характер.
Момент хімічної рівноваги, коли швидкості прямої і зворотної реакції однакові, можна записати так:
 v1 = v2, або
v1 = v2, або
 ,
,
звідки
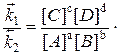
За даної температури константи швидкостей k1 і k2 є сталими
величинами, тому їх відношення  - також стала величина.
- також стала величина.
|

Це рівняння є математичним виразом закону діючих мас для стану рівноваги. Константа рівноваги залежить від температури, зміни ентальпії та ентропії, але не залежить від енергії активації, яка впливає лише на час встановлення рівноваги. Тому каталізатор, знижуючи енергію активації й підвищуючи ентропію активації прямої та зворотної реакцій, прискорює встановлення рівноваги, не змінюючи її константу.
Змінюючи умови, можна перевести систему з одного рівноважного стану в інший, що відповідає новим умовам. Рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій. Характер зміщення рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле Шательє(1884): якщо на систему, що перебуває в стані рівноваги, впливати ззовні, то рівновага зміщується в бік тієї реакції, яка послаблює цей вплив.
Згідно з принципом Ле Шательє:
1) нагрівання сприяє перебігу ендотермічної, а охолодження - екзотермічної реакцій;
2) підвищення тиску зумовлює зміщення рівноваги в бік утворення тих речовин, які займають менший об'єм, а зниження тиску - у протилежний бік. Якщо об'єм системи під час реакції не змінюється, то тиск не впливає на стан рівноваги;
3) введення в систему додаткової кількості будь-якого з реагентів викликає зміщення рівноваги в тому напрямку, в якому його концентрація зменшується. У зв’язку з цим введення в систему вихідних речовин зміщує рівновагу в бік утворення продуктів реакції, а збільшення концентрації продуктів реакції - у бік утворення вихідних речовин;
4) однаково прискорюючи як пряму, так і зворотну реакції, каталізатор сприяє швидкому встановленню рівноваги, не впливаючи на рівноважні концентрації речовин.
Принцип Ле Шательє дає змогу передбачити напрямок реакції за різних умов і, отже, керувати їх перебігом. Він справджується не тільки для хімічних процесів, а має загальнонаукове значення і поширюється на всі процеси, які перебувають у стані динамічної рівноваги.
На практиці принцип Ле Шателье особливо важливий у харчовій промисловості. Визначаючи положення рівноваги для різних температур і тиску, можна вибрати найсприятливіші умови проведення технологічного процесу: необхідно, щоб досягався максимально можливий вихід продукту (зміщення хімічної рівноваги) за найбільшої швидкості його утворення.
Читайте також:
- Активність. Радіоактивна рівновага.
- Баланс сил і рівновага в МС
- Безпека при заготівлі та приготуванні кормів (подрібнення, теплова, хімічна обробка).
- Біохімічна гіпотеза виникнення життя.
- Біохімічна ОБГРУНТУВАННЯ МЕТОДИКИ занять фізичною культурою і спортом з особами різного віку та статі
- Біохімічна характеристика тренованого організму
- Взаємодія попиту і пропозиції та ринкова рівновага.
- Взаємодія попиту і пропозиції. Ринкова рівновага.
- Взаємодія попиту й пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції. Ринкова рівновага
- Взаємодія попиту та пропозиції: ринкова рівновага.
- Взаємозв'язок сукупного попиту та сукупної пропозиції. Макроекономічна рівновага
| <== попередня сторінка | | | наступна сторінка ==> |
| Каталіз | | | ПІДСУМКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |