
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція 2. Ферменти
Основні питання:
1. Хімічна природа ферментів. Номенклатура та класифікація ферментів.
2. Механізм дії ферментів.
3. Активність ферментів, вплив на неї різних факторів.
4. Використання ферментів. Ферментативний аналіз.
Ферменти‑ біологічні каталізатори білкової природи, які утворюються будь-якою живою клітиною та здатні активізувати різноманітні хімічні сполуки. На сьогодні відомо близько 2тис. ферментів.
Організована послідовність процесів обміну можлива лише за умови, що кожна клітина забезпечена особистим генетично заданим набором ферментів. Тільки за цієї умови відбувається узгоджена послідовність реакції (метаболічні шляхи). Ферменти беруть участь також у регуляції багатьох метаболічних процесів, забезпечуючи тим самим відповідність обміну речовин зміненим умовам. Більшість ферментів ‑ білки. Відомі також каталітично активні нуклеїнові кислоти — «рибозими».
За хімічною будовою ферменти класифікують на:
· Однокомпонентні ферменти, ферменти-протеїни (прості ферменти): складаються тільки з поліпептидних ланцюгів, при гідролізі розщеплюються до амінокислот, каталізують процеси гідролізу. Належать ферменти, які складаються тільки з каталітично активного білка. Роль активних груп виконують певні хімічні групування, що входять до складу білка (каталітичні центри, активні центри). Приклади: пепсин, трипсин, рибонуклеаза, уреаза, естераза печінки.
· Двокомпонентні ферменти, ферменти-протеїди(складні ферменти): складаються з білкової частини (апофермент) і небілкового компоненту – кофактор.
Якщо небілковий компонент тісно пов’язаний з білком і відокремлюється тільки при дії денатуруючих факторів – простетична група. Якщо група небілкової природи (кофактор) сполучена з білковою частиною ферменту слабкими електростатичними або Ван-дер-ваальсівськми силами, то вона називається кофермент. Основними коферментами є НАД+, ФАД, КоА.
Каталітичну дію окремо не виявляють ні апофермент, ні кофермент. Каталітичну дію демонструє тільки комплекс (холофермент) – молекула ферменту.
Апофермент зумовлює специфічність взаємодії між ферментом і субстратом.
Кофактор підвищує стійкість білкової частини, може каталізувати інші процеси.
| 
|
| молекула лактатдегідрогенази (ЛДГ) | Лізоцим куриного яйця (простий фермент) |
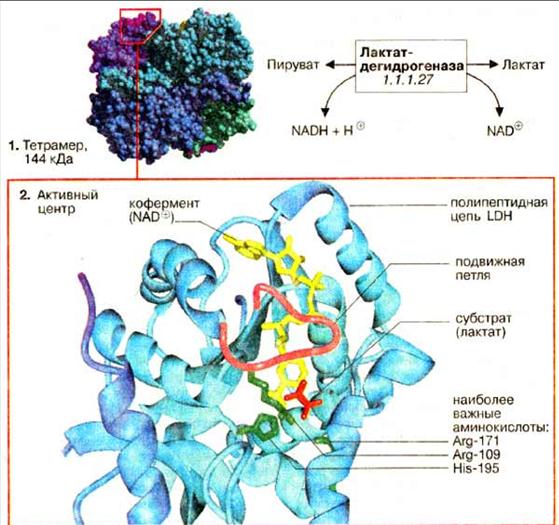
Активною формою лактатдегідрогенази є тетрамерз 4 субодиниць (1) Кожна субодиниця утворена пептидним ланцюгом з 334 амінокислот. В тетрамері субодиниці займають еквівалентні положення; кожний мономер містить активний центр. Пептидний остов білка зображений у вигляді стрічки (світло-блакитний), додатково представлені молекули: субстрату — лактат (червоного кольору), кофермент НАД+ (жовтого кольору), три бічних ланцюга амінокислот (зеленого кольору), які безпосередньо в каталізі. Пептидний ланцюг (малиновий колір), утворена амінокислотними залишками 98-111.
 |  | ||
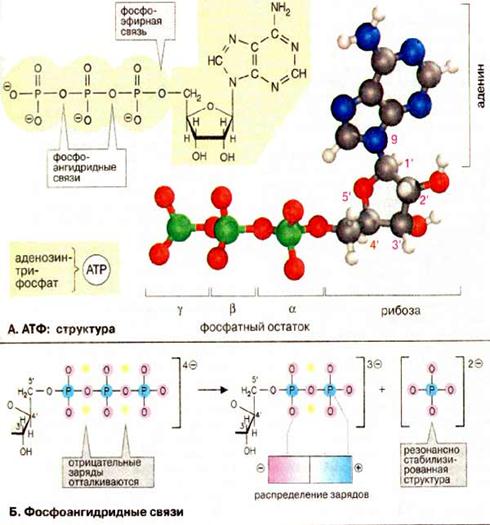
| Нуклеотидний кофермент аденозинтрифосфат [АТФ (АТР)] є найбільш важливою формою збереження хімічної енергії в клітинах. Розщеплення АТФ — високо екзергонічна реакція. Хімічна енергія гідролізу АТФ може використовуватися для спряження з ендергонічними процесами, такими, як біосинтез, рух і транспорт. Інші нуклеозидтрифосфатні коферменти (ГТФ, ЦТФ та УТФ), хімічно подібні до АТФ, виконують в метаболічних процесах інші функції. А. АТФ: структура В АТФ ланцюг з трьох фосфатних залишків сполучений з 5'-OH-групою аденозину. Фосфатні групи позначаються як α, β и γ. Рибоза сполучена з α-фосфатом фосфоефірним зв’язком. Три фосфатні залишки сполучені між собою менш стійкими фосфоангідридними зв’язками. При фізіологічних значеннях рН АТФ несе чотири негативні заряди. Діючим коферментом є комплекс АТФ з іоном Mg2+, координаційно зв’язаним з α- та β-фосфатом. Для простоти говорять тільки про АТФ. Б. Фосфоангідридні зв’язки На схемі: в АТФ атоми кисню всіх трьох фосфатних залишків несуть приблизно однаковий негативний заряд, а атоми фосфори заряджені позитивно. Причиною відносної нестабільності фосфоангідридних зв’язків є сильне відштовхування негативно заряджених атомів кисню, яке послаблюється при гідролітичному відщепленні кінцевої фосфатної групи. Тому такі реакції є високо екзергонічними. При гідролізі АТФ утворюється вільний фосфат-аніон, який краще гідратований і більш ефективно стабілізований, ніж відповідний залишок в АТФ, що сприяє гідролізу АТФ. | |||
| За характером своєї каталітичної дії ферменти поділяють на шість класів: 1. оксидоредуктази або окислювально-відновлювальні ферменти; 2. трансферази, тобто ферменти, що каталізують перенесення різних груп атомів з однієї молекули на іншу. Для дії оксидорекдуктаз і трансфераз обов’язкова наявність спільного коферменту. 3. гідролази, які каталізують гідролітичні реакції; беруть участь у переносі груп, проте акцептором є молекула води. 4. ліази ‑ ферменти, які відщеплюють від субстратів ту чи іншу групу (не шляхом гідролізу) з утворенням подвійного зв’язку, або навпаки, приєднують за подвійними зв’язками; 5. ізомерази, тобто ферменти, що каталізують реакції ізомеризації органічних сполук; 6. лігази або синтетази – до цього класу належать ферменти, що каталізують реакції синтезу (енергозалежні реакції), їх дія пов’язана з гідролізом АТФ. | 
| |||
Розроблена система класифікації враховує реакційну та субстратну специфічності ферментів. Всі ферменти вміщені в «Каталог ферментів» під своїм класифікаційним номером(КФ), який складається з чотирьох цифр. Перша цифра вказує на приналежність до одного з шести головних класів. Наступні дві цифри визначають підклас і підпідклас, а остання цифра — номер ферменту в даному підпідкласі. Наприклад, лактатдегідрогеназа має номер КФ 1.1.1.27 (клас 1, оксидоредуктази; підклас 1.1, донор електрона — СН-ОН; підпідклас 1.1.1, акцептор — НАДФ+.)

А. Некаталітична реакція (у відсутності ферменту): Реакція типу А + В → С + D.
Речовини A та В у розчині оточені оболонкою з молекул води (гідратною оболонкою) та під дією теплового руху безладно переміщуються. При зіткненні та правильної орієнтації в момент зіткнення утворюється активований комплекс. Для утворення продуктів C + D комплекс A—В, повинен утворити перехідний стан, що потребує значної енергії активації, Ea. Оскільки отримати цю енергію може тільки незначна частина комплексів A—В, досягнення перехідного стану — ще більш рідкий випадок, ніж виникнення комплексу. У розчині більша частина енергії активації витрачається на руйнування гідратних оболонок між речовинами A и В, наближення реагентів та інші хімічні процеси, в яких ці реагенти беруть участь. Отже, у відсутності каталізатора утворення продуктів відбувається рідко і швидкість реакції v незначна, навіть, якщо реакція є термодинамічно можливою, тобто ΔG < 0.

| 
|
Б. Ферментативна реакція. Ферментативний каталіз.
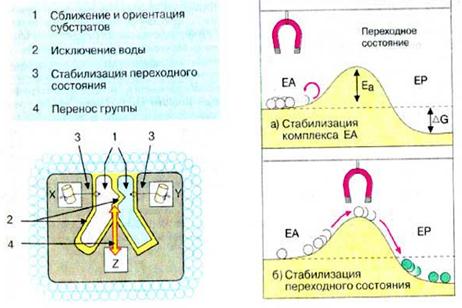
Ферменти специфічно зв’язують реагенти (свої субстрати) в активному центрі. При цьому субстрати орієнтуються таким чином, що набувають оптимального положення для утворенняперехідного стану (1-3). Зближеннята необхідна орієнтаціяреагентів значно підвищують ймовірність утворення продуктивного комплексу A—B. Крім того, зв’язуванню субстрату в активному центрі спричиняє відокремлення гідратної оболонки субстрату. Внаслідок видалення молекул водив активному центрі ферменту під час каталізу створюються зовсім інші умови, ніж у розчині (3-5).Важливим фактором є стабілізація перехідного станувнаслідок взаємодії між амінокислотними залишками білка та субстратом (4).
Висновки:
þ Механізм дії ферментів – утворення фермент-субстратних комплексів; обумовлений зниженням енергії активації, що необхідна для перебігу хімічної реакції, спрямовуючи її крізь проміжні реакції, які вимагають значно меншої енергії активації.
þ Природа каталітичної дії ферментів пояснюється теорією проміжних сполук і адсорбційною теорією.
І етап. Субстрат з’єднується з ферментом за рахунок слабких сил.
ІІ етап. Відбувається активація і видозмінення субстрату з утворенням одного або кількох активованих комплексів, супроводжується розривом і утворенням ковалентних зв’язків.
ІІІ етап. Відокремлення продуктів реакції від ферменту, який змінює молекулу субстрату так, що міцність окремих хімічних зв’язків зменшується, що призводить до зниження енергії активації.
þ Багато ферментів під час каталізу переносять специфічні групування з субстрату або на субстрат. Особливо часто здійснюється перенесення протонів. Такий ферментативнийкислотно-основний каталізє більш ефективним, ніж обмін ферменту.
þ Зв’язування ферменту з субстратом здійснюється через активний центр, який розміщений на поверхні глобул.

| Загальна схема ферментативного каталізу: Е + S → ЕS → ЕS*→Е+П, де Е – фермент; S – субстрат; ЕS – первинний фермент – субстратний комплекс; ЕS* ‑ активований комплекс; П – продукт реакції. |
Активний центр ферменту складається з функціональних груп, які відповідно зорієнтовані у просторі.
Читайте також:
- Біологічні каталізатори – ферменти
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вступна лекція
- Вступна лекція 1. Методологічні аспекти технічного регулювання у
- Дихання мікробів та типи дихання. Ферменти мікробів. Значення ферментів у народному господарстві.
- ІІ. Ферменти. Типи травлення: порожнисте, мембранне, внутрішньоклітинне. Механізм регуляції травлення.
- Клітинна селекція рослин.
- Колекція фонограм з голосами осіб, які анонімно повідомляли про загрозу вибуху
| <== попередня сторінка | | | наступна сторінка ==> |
| Проміжний метаболізм | | | Будова активного центру ферментів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |