
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Основні поняття атомно-молекулярного вчення як фундаменту сучасної хімії
Основні закони хімії
Хімічний елемент
Основні поняття атомно-молекулярного вчення як фундаменту сучасної хімії
 Література
Література
/1/ - Романова Н. В. Загальна та неорганічна хімія. – К.: Ірпінь, ВТФ
«Перун», 2002. – 480 с. (Розділ 1. § 1.1-1.3).
/2/ - Глинка Н. Л. Общая химия. – Л.: Химия, 1987. – 704 с. (Глава 1.
§ 4-12).
У розвитку хімії велику роль відіграло атомно-молекулярне вчення, яке відрізнялось від попередніх теорій своєю логікою. Основи атомно-молекулярного вчення вперше були викладені М. В. Ломоносовим (1741 р.) у праці «Елементи математичної хімії». В основі цього вчення лежить принцип дискретності речовини: будь-яка речовина складається з окремих, дуже малих частинок. Відмінність між речовинами зумовлена відмінністю між їхніми частинками: частинки однієї речовини однакові, частинки різних речовин — різні.
Після утвердження атомно-молекулярного вчення теоретична хімія змогла встановити відмінність між атомними, молекулярними та молярними масами еквівалентів, забезпечити можливість використання єдиних хімічних формул.
Частинки речовини перебувають у безперервному русі за будь-яких умов. Для більшості речовин такими частинками є молекули.
Молекула — це найменша частинка речовини, яка має сталий склад і здатна зберігати основні хімічні властивості цієї речовини.
Молекули простих речовин складаються з атомів одного хімічного елемента, а молекули складних речовин — з атомів різних елементів.
Атом — це найменша хімічно неподільна частинка хімічного елемента, яка зберігає його хімічні властивості.
До складу молекул може входити різне число атомів, наприклад, молекули газів (крім інертних) в основному складаються з двох атомів, а молекули білків — з сотень тисяч атомів.
Розміри атомів виражаються величинами порядку десятих часток нанометра.
Абсолютні маси атомів і молекул дуже малі: маса атома найлегшого елемента (Гідрогену) становить 1,67 · 10-24 г, а маса атома одного з найважчих елементів — Плюмбуму — 3,4 · 10-22 г. Зрозуміло, що такими величинами оперувати незручно, тому в розрахунках використовують не абсолютні значення мас атомів, а відносні.
За одиницю вимірювання маси атомів англійський фізикохімік Дж. Дальтон запропонував прийняти масу атома найлегшого елемента — Гідрогену.
Дещо пізніше шведський хімік і мінералог Й. Я. Берцеліус за елемент порівняння запропонував взяти Оксиген, прийнявши масу його атома за 100. З 1960 р. вважають, що відносна атомна маса Оксигену дорівнює 16, а атомна маса Гідрогену — 1,008.
До 1960 р. існувало дві шкали атомних мас: фізична і хімічна.
В основу фізичної шкали було покладено значення атомної маси нукліда Оксисену 16О, що чисельно дорівнює 16, а в основу хімічної шкали — значення атомної маси природного Оксигену, який є сумішшю різних нуклідів, що чисельно також дорівнює 16. У 1960 р. Міжнародна спілка теоретичної і прикладної фізики, а в 1961 р. Міжнародна спілка теоретичної і прикладної хімії (IUРАС — Іпtеrnаtіоnаl Union Purе аnd Аррlіеd Chemistry) прийняли нову, єдину шкалу атомних мас, за якою маси атомів і молекул порівнюють із 1/12 маси нукліда Карбону 12С. Це зумовлено тим, що в цьому разі відносні атомні маси елементів набувають значень, найближчих до цілих чисел.
Відносною молекулярною Мr (або атомною Аr) масою речовини називають, відношення маси молекули (або атома) m0 даної речовини до 1/12 маси атома Карбону-12 m0C:
Мr =  .
.
Символ Мr, запропонований ІЮПАК, свідчить про відносний характер молекулярної маси (r — relativе — відносний).
Нині відносні атомні маси всіх хімічних елементів визначено досить точно Додавши відносні маси атомів, які входять до складу молекули тієї чи іншої речовини, можна обчислити відносну молекулярну масу цієї речовини.
Чим більше атомів або молекул міститься в речовині, тим більша її маса. Число молекул у макроскопічних тілах надзвичайно велике, тому прийнято
зазначати не абсолютне число атомів і молекул, а відносне. Число молекул або атомів у даній речовині прийнято порівнювати з числом атомів, що містяться в 0,012 кг Карбону. Відносне число атомів і молекул у речовині характеризують фізичною величиною, яка називається кількістю речовини.
Кількість речовини υ — це відношення числа молекул N. що містяться в ній речовині, до числа NА атомів у 0,012 кг Карбону:
υ = N/NА.
Якщо речовина складається з окремих атомів, які не сполучені в молекули, під числом молекул слід розуміти число атомів.
Кількість речовини виражається в молях.
Моль — це така кількість речовини, яка містить стільки молекул, атомів, йонів або інших структурних одиниць, скільки міститься атомів у 0,012 кг нукліда Карбону 12С.
Якщо, наприклад, кількість речовини дорівнює 2 моль, то це означає, що число молекул у речовині в 2 рази більше, ніж число атомів у 0,012 кг нукліда Карбону 12С.
Застосовуючи поняття «моль», потрібно в кожному конкретному випадку зазначати, про які саме структурні одиниці йдеться. Наприклад, слід розрізняти поняття моль атомів Н, моль молекул Н2, моль йонів Н+ .
Число структурних одиниць, що міститься в одному молі будь-якої речовини, називають числом Авогадро (на честь італійського вченого фізика і хіміка). Це число визначено з великою точністю різними методами.
Число Авогадро можна обчислити, знаючи масу одного атома будь-якого елемента, наприклад атома Карбону (m0C = 1,993 · 10-26 кг):
NА = 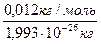 = 6,02 · 1023 1/моль.
= 6,02 · 1023 1/моль.
Якщо кількість речовини υ = 2 моль, то число молекул у ній дорівнюватиме N = υNА = 12,04 · 1023. Число молекул в одному кіломолі речовини становить 6,02 · 1026.
Крім відносної молекулярної маси Мr у хімії і фізиці широко застосовують поняття молярна маса М.
Молярною масою називають масу речовини, взятої в кількості один моль. Згідно з цим визначенням, молярна маса дорівнює добутку маси молекули на число Авогадро:
М = m0 NА.
Молярну масу М можна виразити через відносну молекулярну масу Мr. Оскільки
Мr =  , то m0 =
, то m0 =  .
.
Підставивши значення m0 і NА (NА = 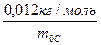 ) у наведену вище формулу, матимемо
) у наведену вище формулу, матимемо
М =  ·
· 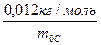 = 10-3 Мr кг/моль.
= 10-3 Мr кг/моль.
Наприклад, молярна маса вуглекислого газу дорівнює 0,044 кг/моль, оскільки відносна молекулярна маса СО2 становить 44.
Масу m будь-якої кількості речовини υ можна обчислити за формулами
m = m0 N = m0 υNА = υМ.
Так, маса 2 моль вуглекислого газу дорівнює m = 2 моль 0,044 кг/моль =
= 0,088 кг.
Вивчаючи реакції між газами і проводячи кількісні дослідження, французький вчений Ж. Л. Гей-Люссак зробив узагальнення, відоме під назвою закону простих об'ємних відношень, або «хімічного» закону Гей-Люссака: за однакових умов об'єми газів, що вступають у реакцію, відносяться один до одного, а також до об'ємів газоподібних продуктів реакції як невеликі цілі числа. Так, під час взаємодії 2 об'ємів водню і 1 об'єму кисню утворюється 2 об'єми водяної пари.
Цей закон привернув загальну увагу хіміків, які намагались пояснити простоту об'ємних співвідношень газів, атоми яких сполучаються між собою.
Найбільш послідовно і досконало дослідив газові реакції італійський фізик Авогадро, що дало йому змогу зробити нові теоретичні узагальнення. В 1811 р. він ввів поняття про молекулу і сформулював свою знамениту гіпотезу, яка після експериментальної перевірки перетворилася на закон. Закон Авогадро формулюється так: в однакових об'ємах різних газів за однакових умов (температури та тиску) міститься однакове число молекул.
Вводячи поняття про молекулу, А. Авогадро не відкидав поняття «атом». Закон Авогадро узгоджувався з фактами, які привели до відкриття закону простих об'ємних відношень, дав змогу зробити висновок про число атомів у молекулах газів, відіграв велику роль у визначенні атомної маси елементів і молекулярної маси речовин.
Згідно з законом Авогадро, однакове число молекул різних газів за однакових умов займає один і той самий об'єм. Виходячи з того, що в 1 моль будь-якої речовини міститься однакове число частинок, які в газоподібному стані займають за певних температури та тиску однакові об'єми, неважко
обчислити об'єм 1 моль газоподібної речовини за нормальних умов (101 325 Па, 0 °С). Наприклад, відомо, що маса 1 л кисню за нормальних умов становить 1,43 г. Щоб знайти об'єм 1 моль кисню, складемо і розв'яжемо пропорцію
1,43 г — 1 л
32 г (1 моль) — х л
х =  ≈ 22,4 л.
≈ 22,4 л.
Обчислення молярного об'єму інших газів (водню, вуглекислого газу тощо) показали, що ця величина стала. Отже, 1 моль будь-якого газу за звичайних умов займає об'єм 22,4 л, або 0,0224 м3 . Цей об'єм називається молярним об 'ємом газу.
Читайте також:
- Cтатистичне вивчення причин розлучень.
- II. Мета вивчення курсу.
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Поняття соціального процесу.
- IV. Вивчення нового матеріалу – 20 хв.
- IV. Вивчення нового матеріалу.
- IV. Вивчення нового матеріалу.
- IІІ. Вивченняння нового навчального матеріалу.
- V. Вивчення нового матеріалу.
- V. Поняття та ознаки (характеристики) злочинності
- А/. Поняття про судовий процес.
- Адвокатура в Україні: основні завдання і функції
| <== попередня сторінка | | | наступна сторінка ==> |
| Розвиток хімії і її сучасні досягнення | | | Хімічний елемент |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |