
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фактори, що впливають на швидкість реакції
Швидкість хімічної реакції залежить від природи речовин, що реагують, і умов перебігу реакції: концентрації С, температури і, наявності каталізаторів, а також від деяких інших факторів (наприклад, від тиску – для газових реакцій, від ступеня подрібнення — для твердих речовин, від радіоактивного опромінення).
Вплив концентрацій реагуючих речовин. Щоб здійснилася хімічна взаємодія речовин А і В, їхні молекули (частинки) повинні зіткнутися. Чим більше зіткнень, тим швидше відбувається реакція. Число таких зіткнень прямо пропорційне загальній кількості молекул, тобто їх концентрації, або добутку концентрацій реакгуючих речовин. Так, швидкість реакції (1) дорівнює
v = К [А] [В],
де [А] і [В] – молярні концентрації вихідних речовин; К – коефіцієнт пропорційності, що називається константою швидкості реакції.
Константа швидкості реакції відповідає швидкості реакції за концентрацій реагуючих речовин, що дорівнюють 1 моль/л.
Швидкість реакції
2А + В = С
можна записати рівнянням
v = К [А] [А] [В] = К [А]2 [В]
тобто концентрація кожної з вихідних речовин входить у вираз швидкості реакції в степені, що дорівнює відповідному коефіцієнту у рівнянні реакції.
Залежність швидкості хімічних реакцій від концентрацій реагуючих речовин була встановлена видатним російським фізикохіміком М. М. Бекетовим, а також норвезькими вченими К. М. Гульдбергом і П. Вааге, які в 1867 р. сформулювали цю залежність, відому нині як закон дії мас: швидкість хімічної реакції за сталої температури прямо пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам.
У загальному вигляді для реакції
аА + bВ + сС + … = …
закон дії мас можна записати так:
v = К [А]а [В]b [С]с …
Закон дії мас справедливий для ідеальних газових систем та розбавлених розчинів для хімічних реакцій, у рівняннях яких сума стехіометричних коефіцієнтів реагуючих речовин не перевищує чотирьох. Для складних реакцій, в яких бере участь велика кількість молекул і паралельно або послідовно відбуваються кілька процесів, зміна швидкості загальної реакції буде складнішою, ніж за законом Гульдберга-Вааге.
Розглянемо застосування закону дії мас на прикладі рівнянь залежності швидкості реакції окиснення оксиду нітрогену(П) та реакції утворення хлороводню від концентрацій реагуючих речовин:
2NO + О2 = 2NО2; v = К [NО]2[О2];
Н2 + Сl2 = 2НСl; v = К'[Н2][Сl2].
Основний закон хімічної кінетики не враховує реагуючих речовин, які перебувають у твердому стані, оскільки їхні концентрації стабільні і вони реагують лише на поверхні. Так, наприклад, для реакції горіння вугілля
С + О2 = СО2
кінетичне рівняння реакції має вигляд:
v = K[O2].
Вплив температури. Залежність швидкості реакції від температури визначається правилом Вант-Гоффа:
при підвищенні температури на кожні 10° С швидкість більшості реакцій зростає в 2-4 рази.
Математично ця залежність виражається співвідношенням

де 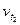 ,
,  , – швидкості реакції відповідно при початковій (t1) і кінцевій (t2) температурах; γ — температурний коефіцієнт швидкості реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури реагуючих речовин на 10° С.
, – швидкості реакції відповідно при початковій (t1) і кінцевій (t2) температурах; γ — температурний коефіцієнт швидкості реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури реагуючих речовин на 10° С.
Правило Вант-Гоффа наближене і застосовується лише для орієнтовної оцінки впливу температури на швидкість реакції. Температура впливає на швидкість хімічної реакції, збільшуючи константу швидкості.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Vу -швидкість ударника
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналіз факторів, що впливають на цінову політику.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Видаток і середня швидкість ламінарного потоку.
- Види опор та їх реакції
- Визначення реакції продуктів, кислотності і лужності.
- Вимірювання інформації та швидкість її передачі
| <== попередня сторінка | | | наступна сторінка ==> |
| Швидкість хімічних реакцій | | | Каталіз |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |