
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції з участю металоорганічних сполук.
Металоорганічні сполуки містять зв’язок вуглець-метал (C-M). По характеру цього зв’язку розрізняють металоорганічні сполуки двох типів: 1) з σ-зв’язком M-С і 2) з π-зв’язком між металом і ненасиченими органічними молекулами або лігандами. Сполуки першого типу утворюють переважно неперехідні метали, другого – перехідні.
В металоорганічних сполуках першого типу полярність і реакційна здатність зв’язків С-М в гетеролітичних реакціях зменшується при переході зверху в низ для сполук IIб і III груп періодичної системи і збільшується для сполук I, IIa, IV і V груп. Термічна стабільність зменшується зверху в низ для сполук III і IV груп, а також при переході від ароматичних сполук до аліфатичних.
Серед металоорганічних сполук другого типу основне місце займають π-комплекси – сполуки перехідних металів, які містять π-зв’язані органічні ліганди (ненасичені органічні і елементоорганічні системи – ароматичні, олефінові, ацетиленові, алільні, циклопентадієнові, карборанові). По характеру зв’язку С-М до них примикають карбонільні, ізонітрильні, ціанідні і карбенові похідні перехідних металів. В таких металоорганічних сполуках зв’язок метал-органічний ліганд здійснюється в результаті взаємодії незаповнених орбіталей ліганда з вакантними орбіталями металу (донорно-акцепторна компонента зв’язку) і в результаті зворотної подачі електронів з орбіталей металу на нижчі вакантні орбіталі ліганда (дативна компонента).
Металоорганічні сполуки отримують по реакціях:
- гідрометалювання – приєднання групи, яка містить метал, і атома водню по кратному вуглець-вуглецевому зв’язку:

Наприклад:
|
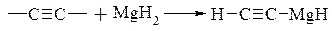
|
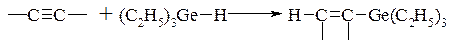
- десульфування (напр. в розбавленій оцтовій кислоті)

- заміщенням діазогрупи в подвійних солях арилдіазонія і галогеніда ртуті під дією порошкової міді (реакція Несмєянова)
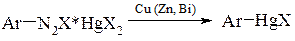
- оксіметалювання – введення в молекулу ненасиченої сполуки метал- і кисневмісних залишків по подвійному вуглець-вуглецевому зв’язку
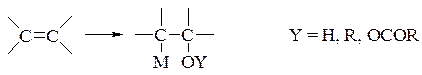
- - оксімеркурування олефінів солями ртуті в водно-лужному розчині має назву реакції Гофмана-Занда

- переметалювання (трансметалювання) – заміна одного метала на інший
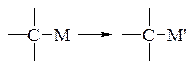
Наприклад:
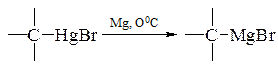

Для металорганічних сполук характерні реакції:
- галогендеметалювання – заміщення металу або групи, яка містить метал, в молекулі органічної сполуки на атом галогена:

Наприклад:
|
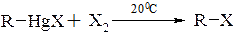
- дегідрометалювання – відщеплення атому водню і залишку, який містить метал, з молекули органічної сполуки з утворенням подвійного вуглець-вуглецевого зв’язку:
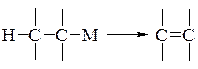
Наприклад:

- деметалювання – заміщення залишку, який містить метал, на інший атом або групу атомів:

Наприклад:

- симетризація – перетворення несиметричних металоорганічних сполук в симетричні:

Наприклад:
|
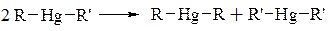
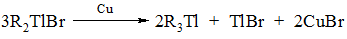
16.1 Синтези за участю магнійорганічних сполук.
Серед металоорганічних сполук найбільш часто використовують синтези за участю магнійорганічних сполук. Магнійорганічні сполуки загальною формулою RMgX отримують при взаємодії металічного магнію з галоїдними алкілами
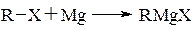
В більшості випадків реакція проводиться в середовищі абсолютного ефіру, рідше тетрагідрофурану або другого простого ефіру (анізол, ди-n-бутиловий ефір), а також диметиланіліну. Використання таких розчинників дозволяє підняти температуру реакційної маси. Всі ці розчинники – апротонні речовини, які мають нуклеофільні властивості. Реакцію також можна проводити в бензені або циклогексані.
Магнійорганічні сполуки дуже чутливі до дії кисню і слідів вологи, тому їх можна зберігати тільки в абсолютизованих розчинниках. Для отримання магнійорганічних сполук, стружку магнію промиту ефіром поміщають в колбу і при перемішуванні поступово добавляють ефірний розчин галоїдного алкілу. Реакція протікає з виділенням тепла, тому галоїдний алкіл вводять зі швидкістю, яка підтримує спокійне кипіння ефіру. Для закінчення реакції реакційну масу деякий час нагрівають на водяній бані. Вихід цільового продукту залежить від будови галоїдного алкілу. Найбільш реакційноздатні алкілйодиди, менше алкілброміди, ще менше алкілхлориди, алкілфториди з магнієм взагалі не реагують.
Магнійорганічні сполуки з найбільшим виходом утворюються з первинних галоїдних алкілів. Наприклад при проведенні реакції з бромистим пропілом утворюється 92% алкілмагнійброміда. З бромистим ізопропілом вихід понижається до 83%, а в реакції з третбутилбромідом замість магнійорганічних сполук утворюються ізобутилен і ізобутан.
Схильність галоїдних алкілів утворювати олефіни замість магнійорганічних сполук падає при переході від йод- до хлор- похідних. Йодистий ізопропіл дає магнійорганічні сполуки з виходом 60%. Тому трет-бутилмагнілгалогенід вдається отримати тільки з відповідного хлориду. Менш активні порівняно з галоїдними алкілами галоїдний вініл і галоїдні арили.
16.2 Реакції магнійорганічних сполук як основ
Магнійорганічні сполуки, які реагують як основи, можуть відривати у вигляді протона рухливий атом водню як з органічних, так і неорганічних сполук. Як правило, реакції такого типу протікають з високою швидкістю, виділенням тепла і незворотньо, так як при цьому утворюються недисоційовані насичені вуглеводні.
Розрізняють HHal-кислоти, ОН-, NH- і СН-кислоти. В першу чергу будуть реагувати найбільш поляризовані безводні галоїдводні

Менш реакційно здатні ОН-кислоти


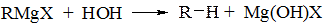
Реакції такого типу використовуються при синтезі індивідуальних насичених вуглеводнів в тих випадках, коли вони менш доступні, ніж спирти або галоїдні алкіли.
Аналогічним чином реагують і NH-кислоти
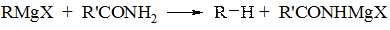
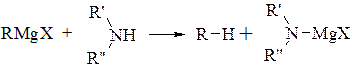
Первинні аміни при охолодженні вступають в реакцію з однією молекулою реактиву Гріньяра, але при підвищенні температури до 100°С в реакцію вступає і другий атом водню


Реакції магнійорганічних сполук з реагентами, які мають рухливий атом водню, використовуються для кількісного визначення активного водню в органічних сполуках (реакція Чугуєва-Церевітінова – число еквівалентів метану, який виділився, відповідає числу активних атомів водню, в первинних амінах реагує тільки один атом водню).


Реакцію проводять в висококиплячому простому ефірі – анізолі або диізоаміловому ефірі.
16.3. Реакції магнійорганічних сполук як нуклеофільних реагентів
В молекулі магнійорганічних сполук на атомі вуглецю, який безпосередньо зв’язаний з магнієм, створюється надлишкова електронна густина, внаслідок чого такі сполуки здатні утворювати ковалентний зв’язок з атомами вуглецю, які мають дефіцит електронної густини. Іншими словами магнійорганічні сполуки можуть бути нуклеофільними реагентами в реакціях нуклеофільного заміщення. Як нуклеофіли реактиви Гріньяра взаємодіють з галоїдними алкілами

Реакція проходить з хорошим виходом для нижчих алкілів, алкенів і алкілбензенів


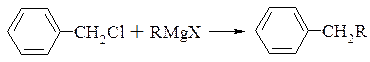
В простих ефірах дефіцит електронної густини на атомі вуглецю менший ніж в галоїдних алкілах. Тому реактив Гріньяра реагує з простими ефірами дуже повільно і при підвищених температурах
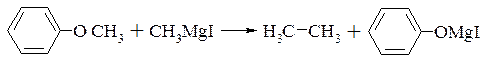
Порівняно легко реактив Гріньяра взаємодії окислом етилена

Реактив Гріньяра взаємодії з галогенідами металів, які в ряду активності знаходяться правіше магнію


При дії на реактив Гріньяра брому або йоду група MgX частково заміщується на відповідний галоїд

Магнійорганічні сполуки здатні взаємодіяти як нуклеофіли з карбонільними сполуками. Оскільки на атомі вуглецю в карбонільних сполуках є дефіцит електронної густини, реактив Гріньяра легко атакує його з утворенням нового вуглець-вуглецевого зв’язку


Реакція проходить краще в присутності безводного бромистого магнію і при використанні надлишку (краще подвійного) реактиву Гріньяра. Побічними реакціями при взаємодії карбонільних сполук з реактивом Гріньяра можуть бути відновлення карбонільної сполуки.
Аналогічно реагує карбонільна група кислотного залишку
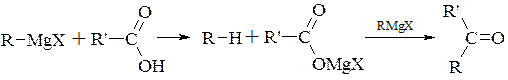
хлорангідридів, ангідридів, складних ефірів, кислот, амідів і солей кислот (в порядку зниження їх активності).
16.4. Радикальні реакції магнійорганічних сполук.
Рушійною силою вже розглянутих реакцій з участю реактиву Гріньяра є надлишкова електронна густина на атомі вуглецю, який зв’язаний з магнієм. В цих реакціях розрив звязку вуглець-магній відбувається гетеролітично, причому електронна пара відходила до вуглецю. Існують реакції, в яких зв’язок вуглець-магній рветься гомолітично.
В першу чергу це реакції з киснем, які приводять до перекисних сполук або при надлишку реактиву Гріньяра до спиртів

Відповідна реакція з сіркою приводить до утворення меркаптанів RSH.
До реакцій, які проходять по радикальному механізму, можна віднести і реакції магнійорганічних сполук в присутності каталітичної кількості хлористого кобальту (реакції Хараша). Хлористий кобальт використовують в кількості 1-5мол.%. Так бромистий феніл реагує з бромистим вінілом з утворенням стиролу

Якщо в реакцію вступає хлористий бензоїл, тоді головним продуктом реакції є дибензоїл,
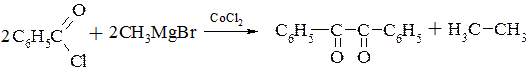
а кетони дають пінакони

Читайте також:
- V. За участю каталізатора
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антигени. Антитіла. Серологічні реакції .
- Біогенні аміни та реакції декарбоксилювання
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
- Види опор та їх реакції
- Визначення реакції продуктів, кислотності і лужності.
- В’язі. Реакції в’язей.
- Гетерогенні реакції.
| <== попередня сторінка | | | наступна сторінка ==> |
| Перегрупування. | | | Задачі для самостійного розв’язку |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |