
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
РОБОТА ВИХОДУ
Якщо в металах є слабко зв'язані рухливі електрони, то природно виникає запитання - чому вони не виходять за межі металу? Ці електрони при звичайних температурах не виходять з металу в навколишній простір тому, що існують сили, які протидіють цьому виходу.
Електрони в металі рухаються з різними швидкостями, і той електрон, що має достатню кінетичну енергію, може вирватися з металу. Але тоді на цей електрон діятиме сила з боку індукованого позитивного заряду поверхні металу, притягуючи електрон назад у метал. Крім того, електрони, яким удалося вилетіти з металу, утворюють над його поверхнею електронну хмарку, густина якої швидко зменшується з віддаленням від поверхні металу. В електронній хмарці встановлюється динамічна рівновага: одні електрони вириваються з металу, а інші повертаються назад.: Можна сказати, що поверхня металу й електронна хмарка утворюють два електричні шари, подібні до пластин зарядженого конденсатора . Товщина позитивного шару в металі становить кілька міжатомних відстаней.
Електронна хмарка заряджена негативно, а метал заряджений позитивно. Різниця потенціалів між електронною хмаркою і металом називається поверхневим стрибком потенціалу, або контактною різницею потенціалів між металом і навколишнім середовищем.Отже, для виходу електрона з металу повинна виконуватися робота проти сил затримуючого електричного поля біля поверхні металу.
Роботу, яку треба виконати, щоб перевести електрон з металу в навколишній простір, називають роботою виходу. Робота виходу електрона з металу дорівнює різниці потенціальних енергій електрона поза металом і всередині металу. Вона для різних металів неоднакова й залежить від стану поверхні металу (забруднення, слідів вологи) і особливо від домішок. Тому металеві катоди в електронних лампах виготовляють з домішками торію, барію, окислів (активовані катоди). При цьому робота виходу електрона зменшується.
2.6.2. КОНТАКТНА РІЗНИЦЯ ПОТЕНЦІАЛІВ. ЗАКОНИ ВОЛЬТА
Експериментальне встановлено, що коли привести в дотикання два різних (незаряджених) метали, то в місці контакту виникає різниця потенціалів, яка називається контактною різницею потенціалів. Вона залежить від хімічного складу металів і температури. У цьому полягає перший закон Вольта. При цьому один метал заряджається позитивно, а другий - негативно. Досліджуючи різні метали, А. Вольта склав ряд, в якому кожний попередній метал у місці контакту з наступним наелектризовується позитивно, а кожний наступний - негативно. Ось цей ряд:

Рис.2.14. Електрохімічний ряд напруг
У ньому кожний попередній метал має меншу роботу виходу, ніж наступний, і електрони переходять від металу з меншою роботою виходу до металу з більшою роботою
виходу. А. Вольта експериментально встановив і другий закон, який полягає в тому, що коли послідовно скласти кілька різних металевих провідників при однакових температурах, то різниця потенціалів між крайніми провідниками не залежить від хімічних властивостей проміжних провідників, а тільки від початкового і кінцевого.
Причин виникнення контактної різниці потенціалів дві: різна робота виходу електронів з металу і різна концентрація електронів провідності в металах.
2.6.3. ТЕРМОЕЛЕКТРИЧНІ ЯВИЩА
Розглянемо два контактних термоелектричних явища - Зеебека і Пельтьє.
1. Зеебек помітив, що коли в колі, складеному з двох різнорідних металів (термопара), контакти мають різну температуру, то в ньому виникає електрорушійна сила. Вона дістала назву термоелектрорушійної сили.Виникнення її пояснюється порушенням термодинамічної рівноваги електронів провідності на контакті двох металів.
Термоелектрорушійна сила прямо пропорційна різниці температур контактів. Проте трапляються випадки, коли залежність термоелектрорушійної сили від температури має складніший характер. Бувають випадки, коли термоелектрорушійна сила спочатку зростає, а потім спадає і може змінити знак на протилежний. Матеріали термопари записують у такій послідовності, щоб у гарячому спаї струм проходив від першого металу до другого. Наприклад, у термопарі мідь - залізо струм у гарячому спаї проходить від міді до заліза; це означає, що мідь позитивна відносно заліза.
Щоб добути постійний струм, треба один спай весь час нагрівати, а другий - охолоджувати. У термоелементі утворена теплова енергія безпосередньо перетворюється в електричну. З точки зору другого принципу термодинаміки електричне поле разом з джерелом теплоти можна розглядати як теплову машину, в якій є нагрівник гарячого спаю з температурою Т1, холодильник - спай з температурою Т2, робоче тіло - електрони провідності.
Явище термоелектрики використовують для вимірювання температур. Один спай термопари вміщують у середовище, температуру якого треба виміряти (наприклад, у горно), а інший - у середовище з відомою температурою. За величиною термо-ЕРС визначають температуру.
Для збільшення чутливості термопар використовують термостовпчики (або термобатареї) - систему послідовно з'єднаних термоелементів. Значно більшу термоелектрорушійну силу дає комбінація металів з напівпровідниками або із самих напівпровідників.
2. Електротермічний ефект Пельтьє в певному розумінні обернений до ефекту Зеебека. Він полягає в тому, що під час пропускання електричного струму через коло, складене з двох різних металів, один спай нагрівається, а другий охолоджується.
Дослід показує, що кількість теплоти Пельтьє пропорційна величині заряду , який переноситься через спай.
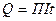 , (2.39)
, (2.39)
Де П – коефіцієнт Пельтьє
Ефект Пельтьє можна використати для утворення штучного холоду (за рахунок електричної енергії) в холодильних установках.
2.7. ЕЛЕКТРИЧНИЙ СТРУМ В РІДИНАХ І ГАЗАХ
План лекції
2.7.1. Електричний струм в рідинах
2.7.2.Електричний струм в газах
2.7.3. Поняття про плазму
2.7.4. Термоелектронна емісія
2.7.1. ЕЛЕКТРИЧНИЙ СТРУМ В РІДИНАХ
Деякі рідини дуже погано пропускають електричний струм (дистильована вода, гліцерин, гас тощо). Це пояснюється тим, що в таких рідинах мало носіїв струму - іонів. Іони являють собою атоми або групи атомів, в яких не вистачає або є надлишок електронів порівняно з нейтральними частинками. Якщо в рідині, наприклад у воді, розчинити сіль, кислоту або луг, то вона стає електропровідною. Це пояснюється тим, що під впливом розчинника молекули розчиненої речовини розпадаються (дисоціюють) на різнойменні іони.
У водних розчинах молекули кислот, солей і лугів взаємодіють з молекулами води, які являють собою досить витягнуті диполі. Молекулярні диполі води оточують полярні молекули кислот, солей або лугів і намагаються їх “розірвати” на іони. Після дисоціації молекули розчиненої речовини на іони останні обволікаються дипольними молекулами розчинника. Цей процес називається сольватацією (для води гідратацією). Розчиняючись у воді, молекули кислот розпадаються на позитивні іони водню Н+ і негативні іони кислотного залишку; молекули лугів - на позитивні іони металу і негативні іони гідроксилу ОН-; солі - на позитивні іони металу і негативні іони кислотного залишку.
Вода також дисоціює на Н+ і ОН-, але в незначній кількості: при кімнатній температурі в тонні води дисоційовано близько 1,4 мг.
Поряд з дисоціацією внаслідок теплового руху і стикання різнойменних іонів відбувається і зворотний процес - відновлення нейтральних молекул (молізація або рекомбінація).
Якщо в посудину з електролітом занурити два електроди й приєднати до них джерело струму, то між електродами виникне електричне поле. На хаотичний рух іонів накладається їх напрямлене переміщення: позитивні іони рухаються до катода - катіони, а негативні - до анода - аніони. На електродах іони нейтралізують свої заряди і перетворюються в нейтральні частинки. Проходження електричного струму через електроліт супроводиться явищем електролізу - виділенням на електродах складових частин розчиненої речовини та інших речовин, які виникають внаслідок вторинних хімічних реакцій. Провідники, в яких проходження струму спричинює електроліз, називаються провідниками другого роду, або електролітами.
М.Фарадей експериментально встановив два закони електролізу.
Перший закон: маса речовини, що виділяється на якому-небудь електроді, прямо пропорційна величині заряду q, який переноситься через електроліт:
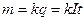 , (2.40)
, (2.40)
де k - електрохімічний еквівалент. Електрохімічний еквівалент чисельно дорівнює масі речовини, яка виділяється в результаті електролізу зарядом 1 Кл.
Другий закон: електрохімічний еквівалент прямо пропорційний хімічному еквіваленту даної речовини:
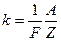 , (2.41)
, (2.41)
де F - число Фарадея; 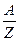 - хімічний еквівалент речовини, безрозмірна величина; А - атомна маса; Z - валентність.
- хімічний еквівалент речовини, безрозмірна величина; А - атомна маса; Z - валентність.
З формул (2.40) і (2.41) дістаємо формулу об'єднаного закону Фарадея:
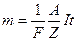 . (2.42)
. (2.42)
Електроліз широко використовують у техніці. У гальваностегіїза допомогою електролізу покривають шаром металу різні предмети (сріблення, золочення, хромування, платинування, цинкування), щоб прикрасити їх або запобігти корозії. Для цього анод беруть з того металу, яким хочуть покрити катод; в електроліті повинні бути іони цього самого металу. Наприклад, щоб посріблити предмет, анод беруть із срібла, а як електроліт використовують розчин АgNО3.
У гальванопластиці електроліз використовують для виготовлення металевих відбитків рельєфних предметів (медалей, монет, музейних експонатів) тощо.
В електрометалургіїдля добування чистих металів використовується електроліз розплавлених солей. Цим способом добувають алюміній, магній, натрій, кальцій тощо.
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- IV. Практична робота.
- VI. Домашня робота.
- VI. Практична робота .
- VI. Практична робота .
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
- VI. Практична робота.
| <== попередня сторінка | | | наступна сторінка ==> |
| ЕЛЕКТРИЧНИЙ СТРУМ В МЕТАЛАХ | | | ЕЛЕКТРИЧНИЙ СТРУМ В ГАЗАХ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |