
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Термодинаміка адсорбції. Рівняння Гібса.
Рівняння Гібса проводить паралель між надлишком адсорбованої речовини в поверхневому шарі Г, концентрацією ПАВ в розчині та поверхневим натягом s.
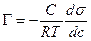
1.ПАР із зростанням с зменшується s 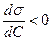
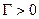
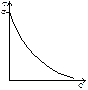
| 
|
2.ПІАР із зростанням с збільшується s…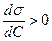 …
…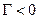
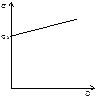
| 
|
3.Речовини, які не впливають на поверхневий натяг
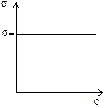
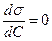
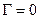
Величина 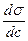 характеризує адсорбційну здатність речовин (здатність адсорбуватись в поверхневому шарі).
характеризує адсорбційну здатність речовин (здатність адсорбуватись в поверхневому шарі).
Поверхнева активність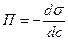
Визначають як tg a дотичної до кривої при даному значенні концентрації

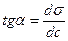
Для кожної концентрації можна розрахувати Г, і тоді ми будемо мати набір 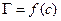 .Така залежність називається ізотермою.
.Така залежність називається ізотермою.
Формула
По мірі збільшення концентрації ПАР адсорбція зростає різко, а потім все повільніше проходить через максимум. Який має назву граничної адсорбції.
Існування 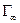 досить легко можна пояснити, виходячи з рівняння Ленгмюра.
досить легко можна пояснити, виходячи з рівняння Ленгмюра.
ПАР у розчині орієнтовані Полярна група, яка має високу спорідненість до води (полярні фази) втягується в воду, в той час, як неполярний радикал, втягується в неполярну фазу.
При збільшенні вмісту ПАР утворюється мономолекулярний шар. При яких концентраціях молекули ПАР плавають на поверхні, це можливо завдяки гнучкості радикалу.
З ростом концентрації ПАР число молекул в поверхневому шарі збільшується, ланцюг припіднімається і приймає верхнє положення.
Частокол Ленгмюра пояснює той факт, що адсорбція зростає із збільшенням ланцюга в гомологічному ряду ПАВ, але для всіх членів ряду криві Г/С прагнуть до одного і того ж значення 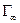 .
.
Малюнок
Насправді любий член ряду буде займати однакове місце на поверхні рідини. Довжина ланцюга не впливає на величину граничної адсорбції. Тому маючи 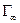 можна визначити, яку площу займає одна молекула в поверхневому шарі якщо
можна визначити, яку площу займає одна молекула в поверхневому шарі якщо  то
то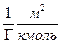 , показує, яку площу займає 1 кмоль речовини при умові, що це не буде щільний мономолекулярний шар, тоді площа, яку займає одна молекула в поверхневому шарі:
, показує, яку площу займає 1 кмоль речовини при умові, що це не буде щільний мономолекулярний шар, тоді площа, яку займає одна молекула в поверхневому шарі:
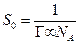
Довжина молекули відповідає товщині шару
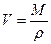 об’єм одного шару молекул 1кмоль
об’єм одного шару молекул 1кмоль
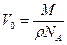 (r - густина речовини в чистому стані 1 молекула)
(r - густина речовини в чистому стані 1 молекула)
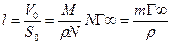
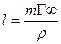 довжина молекули
довжина молекули
Чим довший радикал, тим легше адсорбуються молекули або тим більша їх поверхнева активність.
Правило Траубе:
При продовженні вуглеводневого радикалу на одну групу CH2 поверхнева активність зростаэ в 3 – 3,5 рази.
Читайте також:
- V Процес інтеріоризації забезпечують механізми ідентифікації, відчуження та порівняння.
- Асимптотичний підхід до порівняння оцінок
- Бюджетний контроль - це порівняння показників бюджету зі звітом за відповідний період часу.
- В обох випадках основним розрахунковим рівнянням є рівняння теплопередачі і теплового балансу
- Вивід основного рівняння фільтрації
- Гармонічні коливання. Диференціальне рівняння гармонічних коливань та його розв’язок. Амплітуда, фаза, частота, період коливань
- Головне рівняння відцентрового насоса. Теоретичний напір.
- Два означення інтегралу. Теореми про загальний вигляд інтегралу та залежність двох інтегралів одного диференціального рівняння.
- Десяткові дроби, їх порівняння, операції над ними. Перетворення десяткових дробів у звичайні та звичайних у десяткові.
- Динамічна інтерпретація диференційного рівняння другого порядку. Консервативні системи.
- Диференціальне рівняння
- Диференціальне рівняння Ейлера для потоку рідини.
| <== попередня сторінка | | | наступна сторінка ==> |
| Адсорбція | | | Рівняння Шишковського |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |