
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кінетика гетерогенних реакцій за стаціонарною лінійною дифузією
Гетерогенні процеси, як правило, здійснюються у перемішуваних розчинах, тобто доставка речовини до поверхні розподілу здійснюється шляхом конвекції. Однак, згідно з законами гідродинаміки, потік рідини поблизу поверхні твердого тіла уповільнюється, причому шар рідини молекулярних розмірів, безпосередньо прилеглий до поверхні, міцно утримується на ній. Це так званий дифузійний шар товщиною d, крізь який доставлення речовини до поверхні здійснюється тільки за рахунок дифузії. Всередині шару конвекція відсутня. Концентрація речовини у дифузійному шарі на границі з розчином дорівнює концентрації С0 в об’ємі розчину, а всередині дифузійного шару концентрація речовини зменшується до величини Сs (рис. 12.2). Товщина дифузійного шару не є константою, а залежить від багатьох величин: щільності, в’язкості розчину, швидкості розчину, швидкості перемішування розчину.
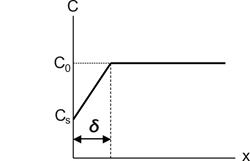
Рисунок 12.2 - Змінення концентрацій реагентів при стаціонарній конвективній дифузії
Нехай швидкість стаціонарної дифузії і швидкість реакції на по верхні однакові. Нехай реакція на поверхні є реакцією першого порядку. Тоді
 , (12.6)
, (12.6)
де k - константа швидкості реакції першого порядку. Замінимо коефіцієнт дифузії D константою швидкості дифузії b. Враховуючи, що b = - D/d, отримуємо рівнян ня першого закону Фіка:
 (12.7)
(12.7)
i
b(С0 - Сs) = kСs. (12.8)
Звідси
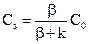 . (12.9)
. (12.9)
Для швидкості реакції W маємо
W = kСs  . (12.10)
. (12.10)
Таким чином, ми виразили швидкість реакції на поверхні через концентрацію речовини в об’ємі. Позначивши bk/(b+k) через k', отримуємо
W = k'C0. (12.11)
Константа швидкості k' макроскопічної реакції пов’язана з дійсною константою швидкості реакції k та константою швидкості дифузії b співвідношенням
 . (12.12)
. (12.12)
Можливі два граничних випадки:
1 Швидкість хімічної реакції на поверхні значно більша за швидкість дифузії, тобто k >> b. Тоді k' = b i W = bС0. Отже, загальна швидкість реакції визначається швидкістю дифузії (найбільш повільна стадія). Цей випадок називається дифузійною областю проходження хімічної реакції. Із (12.9) випливає, що Сs = (b/k)С0, і оскільки k >> b, то Сs << С0, тобто для дифузійної області характерні малі концентрації речовини на поверхні у порівнянні до концентрацією в об’ємі.
2 Швидкість хімічної реакції на поверхні значно нижча від швидкості дифузії k << b. У цьому випадку k' » k і W=kС0. Загальна швидкість реакції знову визначається швидкістю найбільш повільної стадії, тобто швидкістю реакції. Із (12.9) отримуємо Сs » С0, тобто концентрація реагуючих речовин на поверхні та в об’ємі приблизно однакові.
Коли k i b порівнянні один з одним, спостерігається перехідна область.
Механізм гетерогенної реакції залежить від температури та може змінюватися. Це пов’язано з різним характером залежності k i b від температури. Власне кажучи, в обох випадках закон змінення швидкості зі зміною температури можна виразити одним рівнянням:
k = k0 exp( -Ea/RT); 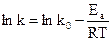 ;
;
(12.13)
b = b0 exp(-ED/RT);  .
.
Однак енергія активації хімічної реакції значно більша за енергію активації дифузії Еа >> ED. Тому із зростанням температури швидкість реакції зростає швидше, ніж швидкість дифузії, і , починаючи з деякої температури, дифузія стає лімітуючою стадією. За низьких температур реакція проходить у кінетичній області (рис. 12.3).

Рисунок 12.3 - Залежність ln k' - 1/T
Читайте також:
- Визначення опорних реакцій трьохшарнірної арки
- Визначення реакцій балки
- Визначення реакцій в’язей
- Викривлення реакцій горя
- Елементи кінетики ланцюгових реакцій
- Ембріологія ока. Вікові особливості зорових рефлекторних реакцій
- ЕНЕРГЕТИКА І КІНЕТИКА РЕАКЦІЙ.
- Закон діючих мас. Константи рівноваги гомогенних реакцій
- Замикання тимчасових зв’язків. Нейронні кореляти формування і прояву умовно-рефлекторних реакцій.
- Кінетика екстракції
- Кінетика зворотних реакцій першого порядку
| <== попередня сторінка | | | наступна сторінка ==> |
| Градієнта концентрацій. | | | Кінетика реакцій за нестаціонарною лінійною дифузією |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |