
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
МЕТОДИ ВИЗНАЧЕННЯ АКТИВНОЇ КИСЛОТНОСТІ
Показник рН визначають колориметричним і електрометричним методами.
Колориметричний (індикаторний) метод базується на властивості індикатора змінювати своє забарвлення в залежності від зміни кислотності досліджуваного розчину. Таким чином, якщо в двох різних розчинах буде однакова кількість іонів водню, то після додавання до них відповідного індикатора, вони будуть мати однакове забарвлення. Якщо забарвлення буде різне, це вказує на різну концентрацію іонів водню. Для колориметричного визначення активної кислотності готується серія буферних розчинів з відомим значенням рН. Буферні розчини мають рН 5,8 – 7,0. До них добавляють індикатор, який змінює забарвлення в цьому діапазоні рН. Отримані розчини застосовують для порівняння з забарвленням досліджуваних розчинів продуктів, до яких додають цей же індикатор.
Крім колориметричного методу можна використовувати метод паперових смужок – це універсальний індикатор у вигляді кольорової шкали, який має діапазон рН 1–10. Смужки паперу, змочені в індикаторі, просушують, і потім використовують для визначення рН. Їх занурюють в досліджуваний розчин і по зміні забарвлення смужки визначають величину рН, зрівнюючи індикаторний папір з кольоровою шкалою. Використовують папір для граничного забарвлення. Даний метод застосовують при титруванні забарвлених розчинів (наприклад в цукровому виробництві).
Електрометричний методбазується на визначенні потенціалу електричного електрода зануреного в досліджуваний розчин, його величина знаходиться в певній залежності від концентрації іонів водню. В даний час для визначення рН застосовують потенціометри з використанням пари електродів каломельного чи хлор-срібного (електроди порівняння) і скляного (вимірювального). Під час занурення електродів у досліджуваний розчин, між ними виникає електрорушійна сила, яку вимірюють потенціометром і виражають показником рН. Використовують лабораторні рН-метри: рН-340, рН-150М та ін.
Потенціометріяоб’єднує методи, які ґрунтуються на вимірюванні ЕРС (електрорушійних сил) гальванічних елементів для визначення активності (концентрації) речовин та вимірювання фізико-хімічних констант. Гальванічний елемент складається з індикаторного електрода та електрода порівняння (стандартного).
Потенціал індикаторного електрода залежить від активності (концентрації) іонів, що визначаються за рівнянням Нернста:
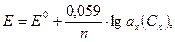 (2.3)
(2.3)
де Е0 – стандартний потенціал, В; 0,059 – коефіцієнт Нернста при 25 °С; n – число електронів, які беруть участь в електродній реакції; ax(Cx) – активність (концентрація) визначуваних іонів, моль\дм3 .
Електрод порівняння (стандартний) – це електрод, потенціал якого відомий і який не залежить від активності (концентрації) іонів, що визначаються й перебігу будь-яких хімічних перетворень у розчині та залишається сталими у процесі вимірювання. Відносно до потенціалу стандартного електроду вимірюється потенціал індикаторного електрода за допомогою визначення електрорушійної сили:
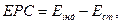 (2.4)
(2.4)
де: ЕРС – електрорушійна сила, В; Ест – стандартний потенціал (електрод порівняння), В; Еінд – індикаторний потенціал (електрод, потенціал якого вимірюється), В.
Знаючи ЕРС і Ест, можна знайти Еінд, тобто потенціал електрода, що вимірюється і залежить від активності (концентрації) іонів досліджуваного розчину.
В якості електродів порівняння використовують стандартний водневий електрод (СВЕ),він є універсальним, його потенціал є умовним нулем шкали потенціалів. Він являє собою пластинку з платини, вкриту платиновою черню, занурену в розчин кислоти, насиченої воднем під тиском 101325 Па. На практиці використовують інші електроди порівняння, величини потенціалів яких відносно до СВЕ є відомими та сталими. Це каломельний електрод – металічна ртуть, вкрита шаром твердої каломелі і занурена у розчин хлориду калію.
Частіше всього використовують хлор-срібний електрод – дротик із срібла, вкритий тонким шаром хлориду срібла і занурений у розчин хлориду калію.
Індикаторні (вимірювальні) електроди: водневий, хінгідронний. Кулька з’єднана з товстостінною скляною трубкою, всередину якої вміщено хлор-срібний контактний електрод.
Читайте також:
- I визначення впливу окремих факторів
- II. Визначення мети запровадження конкретної ВЕЗ з урахуванням її виду.
- II. Мотивація навчальної діяльності. Визначення теми і мети уроку
- Ocнoвнi визначення здоров'я
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адміністративні (прямі) методи регулювання.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Адміністративні методи управління
- Адміністративні, економічні й інституційні методи.
- Адміністративно-правові (організаційно-адміністративні) методи мотивації
| <== попередня сторінка | | | наступна сторінка ==> |
| КЛАСИФІКАЦІЯ ТА СУТНІСТЬ МЕТОДІВ ВИЗНАЧЕННЯ СУХИХ РЕЧОВИН У РОЗЧИНАХ | | | ОКИСНО-ВІДНОВНИЙ ПОТЕНЦІАЛ, ЙОГО ВИЗНАЧЕННЯ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |