
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Побічної підгрупи І групи
Деякі властивості елементів та простих речовин
| Назва елемента | Хі-міч- ний сим-вол | Будова зов-нішнього і передостан нього елек- тронних шарів атома | Радіус атома, нм | Енергія йоніза-ції Е → E+ еВ | Густина, г/см3 | Температура плавлення, °С | Темпе-ратура кипіння, °С | Стандартний електродний потенціал процесу E2+→ E, В |
| Купрум | Cu | 3s23p63d 104s1 | 0,128 | 7,73 | 8.96 | +0.34 | ||
| Аргентум | Ag | 4s24p64d 105s1 | 0.144 | 7,57 | 10.5 | 960.5 | +0.799 | |
| Аурум | Au | 5s25p65d 106s1 | 0.144 | 7,23 | 19.3 | +1.692 |
Хімічна активність елементів підгрупи Купруму невелика. З киснем реагує тільки мідь; благородні метали срібло і золото не взаємодіють з киснем навіть під час нагрівання. Всі елементи підгрупи Купруму (у водних розчинах) розміщені в ряду електрохімічних потенціалів після водню, тому вони не реагують з кислотами-неокисниками. Мідь і срібло розчиняються в нітратній і концентрованій сульфатній кислоті. Золото може розчинятися в гарячій концентрованій Н2SеО4, однак кращими розчинниками для нього є насичений хлором розчин НС1 і царська вода.
Зі збільшенням протонного числа елементів підгрупи Купруму їхня хімічна активність послаблюється. Отже, мідь є найактивнішим металом у своїй підгрупі, а золото — найпасивнішим.
Для елементів підгрупи Купруму, як і для елементів інших побічних підгруп, простежується стабілізація вищих їх ступенів окиснення зі збільшенням протонного числа. Так, йони Аu+ у водному розчині існують тільки у вигляді міцних комплексів, наприклад [Аu(CN2]–.
Для Купруму та його аналогів характерне комплексоутворення. Зв'язки метал – ліганд у комплексних сполуках цих металів значною мірою ковалентні.
Вміст Купруму у земній корі становить 4,7 ∙ 10–10%. Купрум трапляється як у зв'язаному, так і у вільному стані. Маса найбільших самородків міді дося-гає сотень кілограмів. З природних сполук Купруму найбільше значення мають мінерали: мідний колчедан СuFeS2, мідний блиск Сu2S, куприт Сu2О, малахіт (СuОН)2СО3. Природний Купрум складається з двох стабільних нуклідів:
63Сu (69 %) і 65Сu (31 %).
Купрум входить до складу тканин живих організмів. До 0,001 % Купруму виявлено у кістках і зубах тварин. Добрива, що містять Купрум, сприяють росту рослин.
Мідь добувають із сульфідних руд пірометалургійним способом. Це досить складний процес, який включає такі операції: випалювання, плавлення, конвертування, вогняне й електролітичне рафінування. Спочатку концентрат мідної сульфідної руди випалюють у механічних багатоподових печах. При цьому частина сульфіду феруму окиснюється. Оксиди металів (феруму, цинку тощо), які утворюються під час випалювання, відокремлюють у вигляді шлаку в процесі плавлення. Основний продукт плавлення — рідкий купферштейн, в якому міститься весь Купрум, подають у конвертер. Туди ж добавляють кварцовий пісок і крізь всю масу продувають повітря під тиском, при цьому у шлак переходять рештки заліза.
В результаті конвертування оксид купруму(І), що утворився, взаємодіє з рештками сульфіду купруму:
2Сu2О + Сu2S= 6Сu + SО2.
Таким способом добувають мідь із ступенем чистоти 95—97 %.
Для добування міді дуже високого ступеня чистоти метал конвертерного виплавлення піддають електрохімічному афінажу. Розчин СuSО4 є електролітом, як анод беруть неочищену мідь, а катодом служать пластинки чистої міді.
Гідрометалургійні методи добування міді грунтуються на селективному розчиненні мідних мінералів у розбавлених розчинах сульфатної кислоти або аміаку. Із добутих розчинів мідь витісняють залізом або виділяють електролізом. Щорічне світове виробництво міді досягає кількох мільйонів тонн.
Чиста мідь — м'який, блискучий метал червонуватого кольору, легко піддається прокатуванню в тонкі листи. Мідь має дуже високі електро- і теплопровідність, тому її широко застосовують в електротехніці (для виготовлення проводів і кабелів). З міді виготовляють різну промислову апаратуру: котли, перегонні куби тощо.
Кристали міді мають гранецентровані кубічні ґратки.
У газоподібному стані атоми Купруму частково сполучаються у молекули Сu2 (енергія дисоціації молекул становить 174,3 кДж/моль).
Завдяки високим тепло- й електропровідності, великому опору на розрив, хімічній стійкості, ковкості, хорошим ливарним якостям мідь широко використовується у промисловості. Близько 50 % усієї добутої міді йде на виготовлення проводів. Широко застосовуються також сплави міді, найважливішими з яких є латуні (сплави міді з 20—50 % цинку, а також іншими металами), бронзи (сплави міді з оловом, берилієм, алюмінієм та іншими металами) і мідно-нікелеві сплави.
Усі сплави міді мають високу стійкість проти атмосферної корозії.
Мідь — малоактивний метал, у ряду електрохімічних потенціалів вона стоїть після водню, отже, не здатна витісняти водень з розбавлених розчинів кислот.
Мідь легко розчиняється в нітратній кислоті:
3Сu+ 8НNO3 (розб.) = 3Сu(NO3)2 + 2NО↑ + 4Н2О.
У сполуках Купрум виявляє ступені окиснення +1 і +2, але характернішим для нього є ступінь окиснення +2. Сполуки Купруму зі ступенем окиснення +3 дуже нестійкі.
З воднем мідь безпосередньо не взаємодіє, з киснем утворює два оксиди— чорний СuО і червоний Сu2О. Оксид купруму(ІІ) СuО утворюється під час нагрівання міді до 400—500 °С за наявності кисню. СuО внаслідок нагрівання до температури понад 1100 °С розкладається на Си2О і О2. Оксид куп-руму(ІІ) зручно добувати термічним розкладанням основного карбонату купруму (малахіту): t
(СuОН)2СО3 = 2СuО + Н2О↑ + СО2↑.
Оксид купруму(І) Сu2О можна добути, добавляючи до розчину СuSО4 луг і відновник (глюкозу, гідразин, гідроксиламін) під час нагрівання.
Оксид купруму(І) і купруму(ІІ) з водою не взаємодіють, розчиняються у кислотах з утворенням солей Купруму(І) і Купруму(ІІ).
Оскільки для Купруму дуже стійкими є амінокомплекси, то Сu2О і СuО легко розчиняються у водному розчині аміаку:
Сu2О + 4NН3 + Н2О = 2[Сu(NH3)2]ОН;
СuО + 4NН3 + Н2О = [Сu(NH3)4](ОН)2.
Під час сплавляння СuО з лугами утворюються темно-сині купрати
+1
Ме2СuO2.
Під дією лугів на розчини солей Купруму(ІІ) осаджується синій гідроксид Сu(ОН)2. Це слабка основа, що виявляє також слабкі амфотерні властивості, вона розчиняється в концентрованих розчинах лугів з утворенням яскраво-синіх
+1
розчинів тетрагідроксокупратів Ме2[Сu(ОН)4] та аміаку з утворенням сильної комплексної основи [Сu(МН3)4](ОН)2 — гідроксиду тетрамінкупруму(П):
Сu(ОН)2 + 2NaОН = Nа2[Сu(ОН)4];
Сu(ОН)2 + 4NH3 = [Сu(NH3)4](ОН)2.
Всі солі Купруму(ІІ), як солі слабкої основи, здатні сильно гідролізувати. Розчини солей Купруму(П) здебільшого мають кислу реакцію. З слабкими кислотами Купрум утворює основні солі. Сu(ОН)2 під час нагрівання легко розкладається: t
Сu(ОН)2 = СuО + Н2О.
Мідь, як і її аналоги, краще сполучається з сіркою, ніж із киснем. У парі сірки мідь горить з утворенням чорного, не розчинного у воді сульфіду куп-руму(І) Сu2S.
Під дією сірководню на розчинні солі Купруму(П) утворюється чорний осад сульфіду купруму(П) СuS. Осад не розчиняється в розбавлених розчинах хлоридної і сульфатної кислот, але розчиняється під час нагрівання в 2 н розчині HNО3.
–2 +5 0 +2
3СuS + 8НNО3 = 3Сu(NО3)2 + 3S↓ + 2NO↑ + 4Н2О.
Найлегше мідь сполучається з галогенами, особливо з фтором. СuІ2 розкладається в момент утворення:
2Сu2+ + 4I– = 2(СuІ2) = 2СuI↓ + І2↓
Для похідних Купруму (І) характерні реакції диспропорціонування:
+1 0 +2
2СuС1 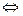 Сu + СuС12.
Сu + СuС12.
З галогенідів Купруму (ІІ) можна добути СuF2 — безбарвну, погано розчинну сіль, а також добре розчинні сполуки амфотерної природи — коричневий СuС1 і чорний СuВr2, які кристалізуються з водних розчинів у вигляді кристалогідратів СuС12 ∙ 2Н2О зелено-блакитного кольору і СuВr2 ∙ 2Н2О коричнево-зеленого кольору. Кристалогідрат СuF2 ∙ 2Н2О має блакитне забарвлення.
Бінарні сполуки Купруму(Н) можуть утворювати як катіонні, так і аніонні комплекси.
Якщо на розчини галогенідів Купруму (ІІ) подіяти надлишком відповідних галогенід-іонів, то можна простежити за зміною забарвлення. Так. зелене забарвлення розчину хлориду купруму (ІІ) зі збільшенням концентрації хлорид-іонів переходить у жовте внаслідок утворення нейтральних [СuСl(Н2О)2] та аніонних [СuСl4]2– комплексів. З таких розчинів можна виділити комплексні сполуки типу К2[СuС14].
Під дією надлишку аміаку на розчини, що містять йони Сu2+, утворюються комплексні йони [Сu(NН3)4(Н2О)2]2+. Темно-сині кристали [Сu(NН3)4]SО4∙Н2О осідають внаслідок добавляння до розчинів СuSО4 і аміаку NH3 етилового спирту, в якому комплексна сполука, що утворюється, мало розчинна.
Із солей Купруму(П) практично важливою є сіль СuSО4 ∙ 5Н2О — мідний купорос. Під час нагрівання мідний купорос зневоднюється. Зневоднений СuSО4 — безбарвний. Мідний купорос застосовують у сільському господарстві для боротьби з шкідниками і хворобами рослин, у виробництві мінеральних фарб та органічних барвників, для електролітичного добування міді.
Сполуки Купруму отруйні.
Вміст Аргентуму у земній корі становить 10–5%. Проста речовина Аргентуму срібло у самородному стані трапляється рідко. У природі Аргентум існує у вигляді сульфідних мінералів: аргентиту Аg2S. піраргіриту Аg3SbS3 інших можна зазначити рогове срібло АgС1. Аргентум має два стабільних природних нукліди: 107Аg (51,35 %) і 109Аg (48,65 %).
Більшу частину срібла добувають пірометалургійним способом під час переробки руд, що містять невелику кількість Аргентуму. Срібло виділяють з неочищених металів (міді, свинцю тощо), в рудах яких завжди містяться домішки Аргентуму. Технічний метал очищають електролізом. Електролітом є нітрат аргентуму, катодом служать пластини з чистого срібла, анодом — технічний метал (афінаж).
Гідрометалургійний спосіб добування срібла застосовують рідше. Для вилучення срібла з руд та відходів інших виробництв сировину спочатку піддають хлоруючому випалюванню з NаСl, а потім діють на подрібнену масу розчином NaСN (за доступу повітря):
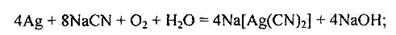 |
АgCl + 2NаСN = Nа[Аg(CN)2]+NaCl.
Після фільтрування срібло виділяють із ціанідного розчину за допомогою цинкового порошку:
2Na[Аg(СN)2] + Zn = Na2[Zn(СN)4] + 2Аg↓.
Чисте срібло — дуже м'який, в'язкий метал білого кольору, досить важкий, густина його становить 10,5 г/см3 Кристали срібла мають гранецентро-вані кубічні ґратки. У газоподібному стані його атоми частково сполучені у молекули (енергія дисоціації молекул становить 157,5 кДж/моль). Срібло краще, ніж інші метали, проводить теплоту й електричний струм.
Через м'якість чисте срібло майже не застосовується. Найширше використовуються його сплави з міддю. Срібні сплави застосовуються для виготовлення радіодеталей, лабораторного посуду, ювелірних виробів, монет.
Вміст срібла (золота) у сплаві зазначається пробою, яка ставиться на виробі. Метрична проба, яку застосовують у нашій країні, вказує, скільки одиниць маси дорогоцінного металу міститься в 1000 одиниць маси сплаву. Найпоширеніші вироби з срібла мають проби 800 і 875.
Срібло — малоактивний метал, в атмосфері кисню не окиснюється навіть під час нагрівання. Під впливом сірководню, який завжди є у повітрі, на поверхні срібла утворюється чорний наліт сульфіду аргентуму Аg2S, внаслідок чого срібні вироби чорніють. Срібло не здатне витісняти водень із розчинів кислот. Розчиняється срібло в нітратній кислоті:
0 +5 +1 +4
Аg+ 2НNOз (конц.) = АgNО3 + NO2↑ + Н2О.
У результаті реакції утворюється нітрат арґентуму — найпоширеніша сіль цього металу. Срібло утворює один ряд солей, розчини яких містять безбарвні йони Аg+. Сполуки Аргентуму(П) дуже нестійкі. Під дією лугів на розчини солей Аргентуму випадає бурий осад оксиду аргентуму Аg2О:
2АgNО3 + 2NaOН = Аg2О↓ + 2NaNO3 + Н2О.
Випадання осаду Аg2О зумовлено тим, що гідроксид аргентуму АgОН може існувати тільки в дуже розбавлених розчинах, під час виділення він розкладається на Аg2О і Н2О. Оксид аргентуму Аg2О дещо розчинний у воді (0,01 г/л за температури 20°С), розчин має лужну реакцію. Очевидно, в розчині є молекули гідроксиду аргентуму АgОН, що є сильною основою. Це підтверджується тим, що солі Аргентуму(І) не гідролізують.
Для Аргентуму(I) характерне комплексоутворення, особливо міцними є амінокомплекси, тому Аg2О добре розчиняється в розчинах аміаку з утворенням сильної комплексної основи:
Аg2О + 4NH3 + Н2О = 2[Аg(NН3)2]ОН.
Сполука [Аg(NН3)2]ОН значно стійкіша, ніж АgОН, і за силою наближається до лугів. Це пояснюється зменшенням поляризаційної дії йона Аg+ на йони ОН– за рахунок екранування їх молекулами аміаку.
Крім оксиду аргентуму(І) Аg2О відомі оксиди АgО і Аg2О3. Оксид Аg2О — бурого кольору, АgО і Аg2O3 — чорного, добути їх можна тільки непрямим способом. Всі ці оксиди належать до солетворних. Кислотно-основна природа їх визначається загальним правилом: від Аg2О до Аg2O3 посилюється кислотна функція, в той час як Аg2О основний, АgО і Аg2O3 — амфотерні.
Під час нагрівання срібла з галогенами утворюються галогеніди. Галогеніди аргентуму, за винятком АgF, у воді не розчиняються. Галогеніди аргентуму, подібно до NaС1, мають кубічні кристалічні ґратки. Хлорид аргентуму забарвлений у білий колір, АgВr — у блідо-жовтий, АgI і АgF — у жовтий. У разі безпосереднього сполучення срібла з фтором утворюється тверда сполука АgF2 коричнево-чорного кольору.
Хлорид аргентуму утворюється у вигляді білого сирнистого осаду внаслідок взаємодії йонів Аргентуму з хлорид-іонами. АgС1 не розчиняється у воді і кислотах, але добре розчиняється в аміаку з утворенням розчинного, досить стійкого (Kнест= 6,8 ∙ 10–8) комплексного йона [Аg(NH3)2]+:
АgС1 + 2NН3 = [Аg(NH3)2]+ + Сl–
Під дією кислот аміакат аргентуму руйнується з утворенням стійкішого,
порівняно з [Аg(NН3)2]+, комплексного йона NH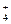 (КнестNH
(КнестNH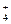 = 5,4 ∙ 10–10):
= 5,4 ∙ 10–10):
[Аg(NH3)2]Сl + 2HNО3 = Аg Сl↓ + 2NH4NO3
АgС1 під час нагрівання помітно розчиняється в концентрованому розчині хлоридної кислоти і в концентрованих розчинах хлоридів лужних металів, ціаніду калію, тіосульфату натрію. Розчинність АgС1 зумовлена утворенням комплексних йонів: [АgСl3]2–, [Аg(СN)2]–, [Аg(S2O3)2]3–.
Бромід аргентуму АgВr не розчиняється у воді й нітратній кислоті, погано розчиняється в аміаку і добре у ціаніді калію і тіосульфаті натрію з утворенням аналогічних комплексів.
Жовтий йодид аргентуму АgI, на відміну від АgС1, не розчиняється в аміаку, оскільки ДРАgI = 8,5 ∙ 10–17, але добре розчиняється в ціаніді калію і
тіосульфаті натрію.
Галогеніди аргентуму на світлі розкладаються з виділенням вільного срібла. Світлочутливість галогенідів аргентуму використовується для приготування світлочутливих емульсій.
Найлегше срібло сполучається з сіркою. Найстійкішою сполукою Аргентуму є сульфід аргентуму(І) Аg2S. Він утворюється під час взаємодії йонів Аg+ з йонами S2 у розчині, а також під час взаємодії срібла з сірководнем або іншими сульфуровмісними сполуками за наявності кисню:
4Аg + 2Н2S + О2 = 2Аg2S+ 2Н2О.
Сульфід аргентуму не розчиняється в аміаку, ціанідах і тіосульфатах лужних металів (ДРAg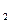 S= 5,9∙1052), але розчиняється під час нагрівання в нітратній кислоті: –2 +5 0 +2
S= 5,9∙1052), але розчиняється під час нагрівання в нітратній кислоті: –2 +5 0 +2
3Аg2S2 + 8НNО3 = 6АgNО3+ 3S↓ + 2NО↑ +4Н2О.
Сполуки Аргентуму легко відновлюються до вільного металу. За певних умов срібло виділяється у вигляді блискучого металу, що міцно закріплюється на поверхні реакційного посуду. В цьому полягає процес сріблення скла. Як відновники беруть різні органічні сполуки, зокрема формальдегід.
Йонам Аргентуму властиве пригнічування розвитку бактерій, вони здатні стерилізувати питну воду навіть за дуже низької концентрації (~10–10моль/л).
Вміст Ауруму у земній корі становить 5∙10–7%. Аурум трапляється у природі практично тільки в самородному стані у вигляді дрібних зерен, вкраплених у кварц. Золото, так само, як і срібло, трапляється в полімета-лічних рудах. З природних сполук Ауруму найбільш відомий калаверитАuТе2. Аурум — моноізотопний елемент.
Із золотих розсипів цей метал добувають відмиванням від пустої породи. Метод добування золота відмиванням ґрунтується на великій відмінності в густині Аu і SіО2. Досить часто відмивання здійснюють одночасно з амальгамуванням. Золото переводять в амальгаму (розчин Аu в Нg), що дає змогу легко відділити його спочатку від пустої породи, а потім і від ртуті (відгонкою останньої).
Широко застосовують хімічний спосіб вилучення золота із золотоносного піску, в якому його вміст в середньому становить 2—4 г/т. Цей метод, розроблений російським інженером П. Р. Багратіоном у 1843 р., грунтується на розчиненні золота в розчині ціаніду калію (натрію), внаслідок чого утворюється розчинний ціанідний комплекс:
4Аu + 8NаСN + 2Н2О + О2 = 4Na[Au(CN)2]+4 NaОН
Із добутого розчину золото витісняють цинком:
2Na[Аu(СN)2] + Zn = Na2[Zn(СH)4] +2Au↓
Щорічне світове виробництво золота становить тисячі тонн.
Золото — яскраво-жовтий, блискучий метал, має гранецентровані кубічні ґратки, досить важке (густина 19,3 г/см:>), м'яке, пластичне, плавиться за температури 1063 °С. Із золота прокатують пластинки завтовшки до 0,0002 мм з 1г золота можна витягнути дріт завдовжки 3,5 км. Золото має високі тепло- й електропровідність (поступається тільки сріблу і міді).
Через велику м'якість золото, як правило, сплавляють з міддю і сріблом. Ці сплави використовуються в ювелірній справі (583 і 750 проби), для зубопротезування, у радіоелектроніці і виробництві ЕОМ (деталі радіоламп, струмопідводи в елементах ЕОМ).
З хімічної точки зору золото — малоактивний метал, через пасивність він називається благородним (як і срібло). Золото не окиснюється на повітрі навіть під час сильного нагрівання. В підгрупі Купруму золото є найпасивнішим металом. Кислоти не діють на золото, і навіть такий сильний окисник, як НNO3, не розчиняє золото. Його можна розчинити в гарячому концентрованому розчині Н2SеО4 і в царській воді (суміш НС1 і HNО3), в насиченому хлором розчині хлоридної кислоти. Розчинення відбувається за рахунок окиснення золота й утворення аніонного комплексу [АuС14] :
0 +5 +3 +2
Аu + НNO3 + 4НС1 = Н[АuС14] + NO↑ + 2Н2О.
У сполуках Аурум може виявляти ступені окиснення +1, +2, +3; найменш характерний для нього ступінь окиснення +2, найбільш характерний+3.
+5
Добуто також сполуки Ауруму(V), зокрема Сs[Аu F6].
Відомі оксиди ауруму: сіро-фіолетовий Аu2О, темно-зелений АuО і темно-коричневий Аu2О3. Добути їх можна тільки непрямими способами.
Під дією лугів на розчини АuС13 або НАuС14 осаджується бурий гідроксид ауруму(Ш) Аu(ОН)з. У разі його висушування утворюється сполука АuО(ОН), а в разі обережного нагрівання до 140—150 °С — оксид Аu2О3. Під час нагрівання до температури понад 160 °С оксид ауруму(ІІІ) розкладається на Аu і О2. Гідроксид ауруму(Ш) — амфотерна сполука, яка під час взаємодії з лугами утворює гідроксоаурати:
Аu(ОН)3 + КОН = К[Аu(ОН)4].
Добуто сполуки, які погано розчиняються у воді К[Аu(ОН)4]∙Н2О (жовтого кольору) та Ва[Аu(ОН)4]2 ∙5Н2О (зеленого кольору).
Для Ауруму більш характерним є утворення тригалогенідів. Крім АuСl3 Добуто АuС12 під дією сухого хлору на порошок металу. Однак у разі надлишку хлору завжди утворюється АuС13. Можна добути бромід та йодид ауруму (Ш), однак вони менш стійкі, ніж АuС13.
Галогеніди, оксид і гідроксид ауруму(ІІІ) — типові амфотерні сполуки, в яких переважають кислотні властивості.
Значно стійкішими, ніж прості галогеніди, є комплексні солі Ауруму. Так, АuІ3 легко розкладається, а за цих самих умов комплексна сіль К[АuІ4] стійка.
Під дією галогеноводнів АuГ3 утворюють досить сильні тетрагалогено-ауратні кислоти типу Н[АuС14]. Остання кислота відома у вигляді кристалогідрату Н[АuС14] ∙4Н2О; під назвою «золота кислота» її добувають випарюванням розчину золота у царській воді. Відомі також солі цієї кислоти, серед яких найпоширенішою є «золота» сіль Na[АuС14] ∙ 2Н2О.
З інших комплексних кислот і солей Ауруму відомі диселенатоауратна кислота Н[Аu(SеО4)2], яка утворюється під час розчинення золота у гарячому концентрованому розчині Н2SеO4, та погано розчинний кристалогідрат Ва[Аu(ОН)4]2∙Н2О зеленого кольору. Добуто також дисульфатоаурат калію К[Аu(SО4)2] жовтого кольору.
Існує ряд сполук Ауруму(І). Крім оксиду ауруму(І) Аu2О добуто АuСl та АuІ. У водному розчині йони Аu+ диспропорціонують на Аu(ІІІ) і Аu(0), проте йони Аu+ стійкі у ряді комплексних сполук, зокрема в сполуці [Аu(СN)2]-.
Сполуки Ауруму є окисниками і відновлюються значно легше, ніж сполуки Аргентуму. Усі сполуки Ауруму легко розкладаються під час нагрівання з виділенням металічного золота. Розчинні сполуки Ауруму отруйні.
До побічної підгрупи II групи належать елементи Цинк Zn, Кадмій Сd, Меркурій Нg. Zn, Сd і Нg — повні аналоги, це останні d-елементи, кожен у своєму періоді. В атомах цих елементів повністю стабілізований d10-підрівень передостаннього енергетичного рівня. Завдяки більш високому заряду ядер атомів елементів підгрупи Цинку, порівняно з передуючими в періодах атомами Сu, Аg, Аu, зв'язок d-електронів у атомах Zn, Сd, Нg з ядром міцніший. Тому елементи підгрупи Цинку виявляють у сполуках ступінь окиснення не вищий, ніж +2.
У табл. 5.2.2 подано деякі властивості елементів побічної підгрупи II групи.
Таблиця 5.2.2.
Читайте також:
- Алгоритми групи KWE
- Важливою ознакою класифікації є принцип побудови перетворювачів кодів, згідно з яким їх можна поділити на чотири групи.
- Варіанти групи крові
- Види небажаної (побічної) дії ліків
- Види небажаної (побічної) дії ліків
- Вимоги до керівника групи
- Вимоги до професійних і особистісних якостей керівника групи АСПН
- Витрати, пов'язані з одержанням освіти, можна розділити на три групи
- Відмінювання іменників другої відміни. Особливості поділу на групи іменників з основою на –р. Особливості відмінкових закінчень іменників другої відміни родового відмінка.
- Відновлення металів може проводитись різними методами, які зручно об'єднати в такі групи: пірометалургійні, гідрометалургійні та електрометалургійні.
- Віковий підхід і взаємодія різних рівнів соціального досвіду в діяльності різновікових дитячих об’єднань. Функції різновікової групи.
- Властивості елементів підгрупи берилію
| <== попередня сторінка | | | наступна сторінка ==> |
| Мідь, Цинк, Титан, Хром, Залізо, Нікол, Платина. | | | Підгрупи II групи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |