
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція №2. Білки
Основні питання:
1. Білки, їх амінокислотний склад. Харчова цінність.
2. Біологічна роль білків в організмі.
3. Будова і класифікація білків.
4. Фізичні та хімічні властивості білків.
5. Колоїдний стан білків у харчових продуктах.
6. Методи розділення та очищення білків.
7. Методи визначення білків.
8. Функціональні властивості білків та методи їх регулювання.
Білки– високомолекулярні органічні сполуки, що побудовані із залишків α-амінокислот, які сполучені між собою пептидними зв’язками в довгі поліпептидні ланцюги (прямі і закручені). Молекулярна маса білків коливається в діапазоні від кількох тисяч (інсулін – 5700) до сотень мільйонів (білок вірусу грипу – 322млн.).
Ф.Кене в 1747 р. – термін “білки”; Н.Мульдер в 1838 р. – термін “протеїни”.
| До складу білків входять 20 α-амінокислот. Всі амінокислоти білків за виключенням гліцину є L-стереоізомерами. α-Амінокислоти відрізняються одна від одної структурою і складом групи (бічного ланцюга). | Загальна формула α-амінокислоти | 
|
D-амінокислоти не знайдені в білках. Проте, D-форми амінокислот виділені з різних організмів у вільному стані, або у складі пептидів. Вони входять до складу мукопептидів клітинних стінок діяких мікроорганізмів, є компонентами пептидних антибіотиків (граміцидину, актиміцину).
B aмінoкиcлотax містяться дві іоногенні групи тому їх сyмapний зapяд залежить від значення pH середовища.
NH2 – CH2 – COOH ↔ +NH3 – CH2 – COO-
гліцин внутрішня сіль
В молекулі гістидину поряд з карбоксильною та аміногрупою наявний імідазольний залишок.
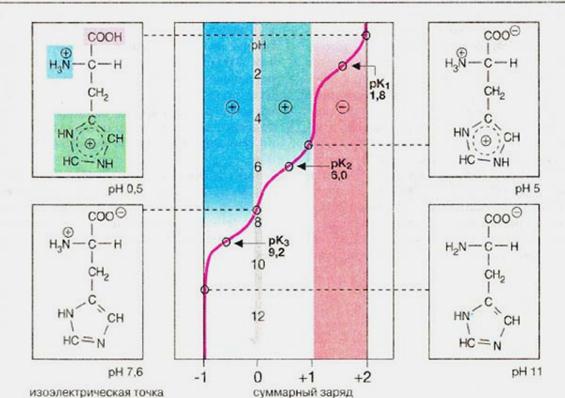
| Тому при підвищенні рН середовища заряд гістидину змінюється від +2 до -1. При рН = 7,6 сумарний заряд дорівнює нулю, назважаючи на наявність двох повністю іонізованих груп в молекулі гістидину. Величина рН, при якій сумарний заряд дорівнює нулю, називається ізоелектричною точкою. В ізоелектричній точці гістидин є цвіттер-іоном, тобто молекула виявляє властивості як аніона так і катіона. B нейтральній області рН більшість амінокислот також є цвіттер-іонами. |
Біологічна роль амінокислот:
1. Стpуктуpні елементи пептидів і білків.До складу білків входять 20 протеїногенних амінокислот, які кодуються генетичним кодом, і постійно містяться в білкax.
2. Структурні елeмeнти інших природних сполук.Aмінoкиcлoти та їх похідні входять до складу коферментів, жовчних кислот, антибіотиків.
3. Пepeнoсники сигналів.Деякі aмінoкиcлoти є нейромедіаторами або попередниками гормонів і нейромедіаторів.
4. Метаболіти.Амінoкиcлоти — життєво важливі компоненти харчування. Деякі амінокислоти беруть участь в обміні речовин, слугують донорами азоту. Непротеїногенні aмінoкиcлoти утворюються в якості проміжних продуктів при біоcинтeзі та деградації протеїногенних амінокислот або в циклі сечовини.
Білки є основною азотистою сполукою харчових продуктів, забезпечують до 15% енергоцінності добового раціону. Добова потреба людини в білках – 80-90г, половину з яких повинні складати тваринні білки.
За біологічним значенням амінокислоти поділяють на замінні і незамінні.Незамінні амінокислоти: триптофан, лізин, фенілаланін, лейцин, ізолейцин, метіонін, треонін, валін. Вони не можуть синтезуватися організмом людини, і повинні поступати з їжею. Аргінін і гістидин є незамінними для дитячого організму (у дорослих частково синтезуються).
Вміст білків у харчових продуктах:
| м’ясо | 14 ‑ 20% | риба | 13 ‑ 18% | |
| сир твердий | 22 ‑ 29% | сир кисломолочний | 15 ‑ 16% | |
| яйця | 12 ‑ 14% | крупи | 7,6 ‑ 4,9% | |
| соя | 33 ‑ 44% | молоко | 3 ‑ 4% | |
| хліб пшеничний | 6 ‑ 10% | картопля | 2% | |
| овочі | 0,5 ‑ 6,5% | фрукти | 0,2 ‑ 1,5% |
Білки становлять структурну і функціональну основу всіх живих організмів. В рослинах вміст білків значно менший, ніж в організмах тварин.

| Органи і тканини тварин | Вміст білка (в% від маси) | Органи і тканини рослин | Вміст білка (в% від маси) |
| м’язи | 18 ‑ 23 | насіння | 10 ‑ 13 |
| печінка | 18 ‑ 19 | стебло | 1,5 – 3,0 |
| легені | 14 ‑ 15 | листя | 1,2 – 3,0 |
| нирки | 16 ‑ 17 | коріння | 0,5 – 3,0 |
| мозок | 7 ‑ 9 | плоди | 0,3 – 1,0 |
 |

8Структурна функція. Забезпечується структурними білками, які відповідають за підтримання форми і стабільності клітин і тканин. Приклади: колаген, гістони (організують укладання ДНК в хроматині).
8Транспортна функція. Забезпечується білками: гемоглобін (переносник кисню та вуглекислого газу до тканин і легень), преальбумін (переносник гормонів щитовидної залози – тироксин і трийодтиронін), іонні канали (транспорт іонів і метаболітів через біологічні мембрани).
8Захисна функція. Забезпечує білок-імуноглобулін G, який утворює на еритроцитах комплекс з мембранними гліколіпідами.
8Регуляторна функція. В біохімічних сигнальних ланцюгах білки виконують функції сигнальних речовин (гормонів) і гормональних рецепторів. Наприклад, комплекс гормону росту соматотропіну з відповідним рецептором, інсулін (гормон, що регулює вуглеводний обмін).
8Каталітична функція.Забезпечують ферменти.
8Рухома функція.Взаємодія актину з міозином відповідає за м’язові скорочення та інші форми біологічної рухомості.
8Запасні функції. Забезпечуються запасними білками, які містяться в рослинах, і є цінними харчовими речовинами. В організмах тварин м’язові білки служать резервними харчовими речовинами, які мобілізуються при потребі.
8Енергетична функція(джерело енергії). При розщепленні 1г білка виділяється 17,7кДж енергії.
 | |||
 |
Структура білкових молекул вивчалася видатними хіміками:
О.Я. Данілевський (1888 – 1891) – український хімік; Е.Фішер (1899 – 1919) – німецький хімік-органік; М.Д.Зелінський (1906 – 1934) – російський хімік-органік; Л.Полінг (1946 – 1951) – американський фізик і хімік.
| Рівні структурної організації білкової молекули Головними структурними одиницями, які формують білкову молекулу, є 20 амінокислот, 2 аміди (аспарагін і глютамін) і 2 імінокислоти (пролін і оксипролін). Протеїногенні амінокислоти (α-амінокислоти) утворюють пептиди і білки. Назва пептиду складається: назва першої N-кінцевої амінокислоти з вільною NH2-групою (закінчення -ил, -іл типове для ацилів) + назва наступних амінокислот (також із закінченнями –ил, -іл) + повна назва С-кінцевої амінокислоти з вільною СООН-групою. Наприклад, пентапептид з 5 амінокислот може бути названий: гліцил-аланіл-серил-цистеінил-аланін, або скорочено Гли–Ала–Сер–Цис–Ала. | 
| ||||

| Схема утворення трипептиду. Хімічний синтез поліпептидів і сучасні фізико-хімічні методи дослідження білків повністю підтвердили наявність пептидних зв’язків в структурі білка. | ||||
 |

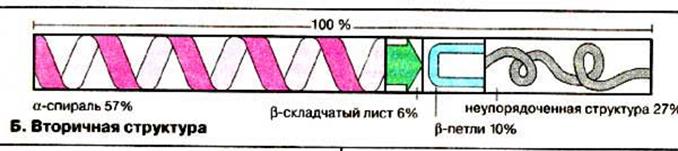
 Вторинна структура
Вторинна структура
| |

| 
|
| α-спіраль | β-структура |
| Третинна структура молекули білка утворюється внаслідок взаємодії між боковими відгалуженнями поліпептидних ланцюгів. Це призводить до формування водневих, дисульфід них, іонних (сольових), вандерваальсових та інших зв’язків. Поліпептидні ланцюги згортаються в певному порядку, що призводить до утворення просторової конфігурації білкової молекули. При цьому гідрофобні радикали «втягуються» всередину молекули, а гідрофільні орієнтуються в бік розчинника, створюючи енергетично вигідну конфігурацію білкової молекули. Четвертинна структура білкової молекули є асоціацією декількох субодиниць поліпептидної природи, мають первинну, вторинну і третинну структури, або глобул, що сполучені у єдину складну молекулу. Окремі субодиниці називаються протомери, а їх комплекс – мультимер. Кількість протомерів – різна: від 4 у гемоглобіні до кількох тисяч у білка тютюнової мозаїки. Підтримується слабкими взаємодіями. Реалізується в глобулярних білках. | 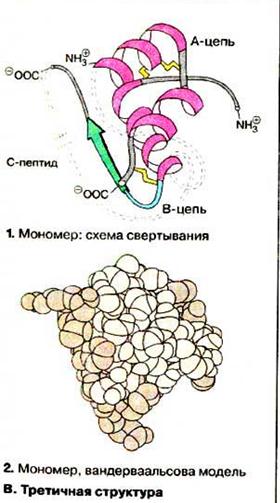
| 
|

 Класифікація білків:
Класифікація білків:
Ø За будовою молекули: глобулярні і фібрилярні;
Ø За складом молекул: прості (протеїни) і складні (протеїди);
Ø За розчинністю: у воді, солях, у кислотах;
Ø За фізичним станом: тверді, рідкі, напіврідкі;
Ø  За харчовою цінністю: повноцінні, неповноцінні.
За харчовою цінністю: повноцінні, неповноцінні.

Структура молекули білка дуже лабільна й легко змінюється під впливом різних факторів, що приводить до зміни їх нативних властивостей – фізичних, фізико-хімічних і біологічних властивостей.
Фактори, що впливають на зміну структури і стану білків:
t температура;
t механічний вплив (струшування, збивання);
t дія лугів, кислот;
t дегідратація при сушінні або заморожуванні.

 Фізико-хімічні властивості білків:
Фізико-хімічні властивості білків:
a Рідкі, напіврідкі, тверді аморфні та кристалічні речовини. Деякі білки мають консистенцію в’язких рідин або драглів (альбуміни, глобуліни сироватки крові).
a При високій температурі всі білки згоряють, відчувається запах паленого волосся.
a Не мають температури плавлення та кипіння, так як згортаються при нагріванні.
a Оптично активні речовини. Розчини природних білків обертають площину поляризації світла ліворуч так як складаються переважно з α-амінокислот.
a Розчинність білків ‑ різна: нерозчинні (колаген, еластин), альбуміни розчиняються у воді з утворенням колоїдних розчинів, проламіни – у сумішах спиртів.
a Білки утворюють колоїдні розчини, які здатні переходити в гелі (драглеподібний стан). Наприклад, перехід із золю в гель спостерігається під час охолодження драглів. Білки опірних тканин лише набухають і можуть зв’язувати воду в набагато більших кількостях, ніж їх маса.
a Практично всі білки погано кристалізуються.
a  Білки є амфотерними сполуками, їх властивості визначаються наявністю в складі їх макромолекул різних функціональних груп, здатних до іонізації в водних розчинах (карбоксильна і гідроксильна групи). Ступінь іонізації функціональних груп залежить від значення рН середовища. В кислому середовищі пригнічується дисоціація карбоксильних груп, і молекула набуває сумарного позитивного заряду – білок виявляє властивості катіону (переважають позитивно заряджені іони) – реагує як основа, а у лужному середовищі пригнічується іонізація аміногруп, і білок набуває сумарного негативного заряду, виявляє властивості аніону – реагує як кислота.
Білки є амфотерними сполуками, їх властивості визначаються наявністю в складі їх макромолекул різних функціональних груп, здатних до іонізації в водних розчинах (карбоксильна і гідроксильна групи). Ступінь іонізації функціональних груп залежить від значення рН середовища. В кислому середовищі пригнічується дисоціація карбоксильних груп, і молекула набуває сумарного позитивного заряду – білок виявляє властивості катіону (переважають позитивно заряджені іони) – реагує як основа, а у лужному середовищі пригнічується іонізація аміногруп, і білок набуває сумарного негативного заряду, виявляє властивості аніону – реагує як кислота.
Білки можуть мати:
· кислотний характер (складаються переважно із залишків двох основних кислот);
· лужний характер ( в їх складі більшість аміногруп);
· нейтральний характер (однакова кількість карбоксильних і аміногруп в їх молекулі).
Залежно від знака заряду молекула білка в електричному полі переміщується відповідно до катода або анода. При певному значенні рН середовища кількість позитивно і негативно заряджених груп у складі молекули білка урівноважується, тобто молекула стає електронейтральною.
Значення рН середовища, при якому молекула білка містить однакову кількість позитивно і негативно заряджених груп, називається ізоелектричною точкою білка.
Ізоелектрична точка білка характеризується:
ü найменшою розчинністю білка і випадінню його в осад при додаванні водовідбірних агентів (внаслідок втрати заряду молекули);
ü втратою здатності рухатися в електричному полі до позитивно або негативно зарядженого полюсів.

Читайте також:
- Білки молока
- Білки яєць
- Білки – це високомолекулярні органічні біополімери, мономерами яких є амінокислоти.
- Білки, властивості, роль в життєдіяльності організмів.
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вступна лекція
- Вступна лекція 1. Методологічні аспекти технічного регулювання у
- Клітинна селекція рослин.
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічний склад живих організмів | | | Зміна колагену при тепловій обробці |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |