
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розподіл Максвелла.
Теплова швидкість молекул газу – це деяка усереднена характеристика теплового руху частинок. У дійсності різні молекули рухаються з різними швидкостями і можна поставити питання про розподіл молекул за швидкостями: скільки (у середньому) з наявних у газі молекул має ті чи інші швидкості?
Стан газу будемо вважати рівноважним. Для наочного уявлення швидкостей молекул газу скористаємося наступним прийомом. Введемо уявний простір швидкостей ( 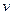 - простір), у якому будемо відкладати уздовж прямокутних координатних вісей значення компонент швидкостей
- простір), у якому будемо відкладати уздовж прямокутних координатних вісей значення компонент швидкостей 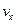 ,
, 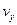 ,
,  окремих молекул (рис. 1). Тоді кожній молекулі буде відповідати в просторі швидкостей точка. Щоб відрізнити цю точку від довільної точки
окремих молекул (рис. 1). Тоді кожній молекулі буде відповідати в просторі швидкостей точка. Щоб відрізнити цю точку від довільної точки 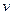 -простору, умовимося називати точку, що зображує швидкість молекули, м-точкою, а довільну точку
-простору, умовимося називати точку, що зображує швидкість молекули, м-точкою, а довільну точку 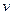 -простору – геометричною точкою.
-простору – геометричною точкою.
 Оскільки газ знаходиться в рівновазі, усі напрямки руху молекул рівноправні, унаслідок чого розташування м-точок відносно початку координат виявляється сферично-симетричним. Тому густина м-точок (їхня кількість в одиниці об'єму
Оскільки газ знаходиться в рівновазі, усі напрямки руху молекул рівноправні, унаслідок чого розташування м-точок відносно початку координат виявляється сферично-симетричним. Тому густина м-точок (їхня кількість в одиниці об'єму 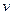 -простору) є функцією відстані від початку координат, тобто функцією модуля швидкості
-простору) є функцією відстані від початку координат, тобто функцією модуля швидкості 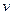 .
.
Якщо збільшити кількість молекул газу в деяку кількість разів, то в стільки ж разів зросте усюди густина м-точок. Отже, густина м-точок пропорційна 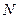 . Відповідно до цього представимо густину м-точок у виді
. Відповідно до цього представимо густину м-точок у виді
 (20.3)
(20.3)
Знаючи вид функції  , можна вирішити ряд задач. Наприклад, знайти кількість молекул
, можна вирішити ряд задач. Наприклад, знайти кількість молекул 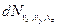 , компоненти швидкості яких укладені в межах інтервалів
, компоненти швидкості яких укладені в межах інтервалів 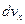 ,
, 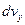 ,
,  , що лежать в околиці геометричної точки з координатами
, що лежать в околиці геометричної точки з координатами 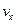 ,
, 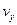 ,
,  . Для цього потрібно густину м-точок у даній геометричній точці помножити на об'єм прямокутного паралелепіпеда зі сторонами
. Для цього потрібно густину м-точок у даній геометричній точці помножити на об'єм прямокутного паралелепіпеда зі сторонами 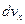 ,
, 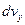 ,
,  ( рисунок 20.1). Таким чином,
( рисунок 20.1). Таким чином,
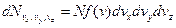 . (20.14)
. (20.14)
На рисунку 20.1 зображена штриховою лінією кульовий шар радіуса 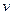 і товщини
і товщини  . Молекули, м-точки яких знаходяться в цьому кульовому шарі, мають швидкості, модулі яких лежать в інтервалі від
. Молекули, м-точки яких знаходяться в цьому кульовому шарі, мають швидкості, модулі яких лежать в інтервалі від 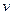 до
до  . Щоб знайти число
. Щоб знайти число  таких молекул, потрібно помножити густину м-точок, що відповідає даному значенню
таких молекул, потрібно помножити густину м-точок, що відповідає даному значенню 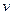 , на об’єм шарового шару, рівний
, на об’єм шарового шару, рівний 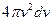 :
:
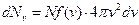 . (20.15)
. (20.15)
Поділивши цей вираз на кількість молекул 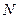 , знайдемо ймовірність
, знайдемо ймовірність  того, що модуль швидкості молекули в межах від
того, що модуль швидкості молекули в межах від 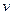 до
до  :
:
 . (20.16)
. (20.16)
Згідно формули (20.6) вираз 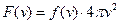 є функцією розподілу ймовірності значень
є функцією розподілу ймовірності значень 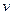 .
.
Функцію  отримав теоретично Д.К.Максвелл. Вона має вигляд
отримав теоретично Д.К.Максвелл. Вона має вигляд
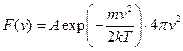 , (20.17)
, (20.17)
де  – маса молекули,
– маса молекули, 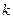 – стала Больцмана,
– стала Больцмана, 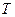 – абсолютна температура. Коефіцієнт пропорційності
– абсолютна температура. Коефіцієнт пропорційності  визначається з умови
визначається з умови
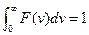 , (20.18)
, (20.18)
яка називається умовою нормування функції  (див. формулу (20.8)). З приводу верхньої межі інтегрування треба зробити наступне роз'яснення. Значення модуля швидкості молекул газу не може перевищити деяке хоча і дуже велике, але кінцеве значення. Однак через експонентний множник функція
(див. формулу (20.8)). З приводу верхньої межі інтегрування треба зробити наступне роз'яснення. Значення модуля швидкості молекул газу не може перевищити деяке хоча і дуже велике, але кінцеве значення. Однак через експонентний множник функція  зменшується настільки швидко, що при досить великих значеннях
зменшується настільки швидко, що при досить великих значеннях 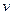 вона практично не відрізняється від нуля. Тому розширення верхньої межі інтегрування до нескінченності не вносить відчутної помилки.
вона практично не відрізняється від нуля. Тому розширення верхньої межі інтегрування до нескінченності не вносить відчутної помилки.
Відповідний розрахунок дає для коефіцієнта пропорційності  значення
значення 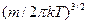 . Напишемо з урахуванням цього остаточний вираз для функції розподілу молекул газу за швидкостями:
. Напишемо з урахуванням цього остаточний вираз для функції розподілу молекул газу за швидкостями:
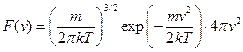 . (20.19)
. (20.19)
Ця функція називається функцією розподілу Максвелла.
Відзначимо, що під знаком експоненти у формулі (20.19) знаходиться відношення кінетичної енергії молекули (що відповідає даному значенню швидкості 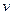 ) до величини
) до величини 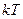 , що характеризує середнє (за молекулами) значення цієї енергії.
, що характеризує середнє (за молекулами) значення цієї енергії.
 Графік функції (20.19) наведений на рис. 2. Найбільш ймовірною буде, мабуть, швидкість, що відповідає максимуму функції
Графік функції (20.19) наведений на рис. 2. Найбільш ймовірною буде, мабуть, швидкість, що відповідає максимуму функції  . Її значення
. Її значення  можна знайти, якщо прирівняти до нуля похідну
можна знайти, якщо прирівняти до нуля похідну  . Опустивши у виразі (20.19) множники, що не залежать від
. Опустивши у виразі (20.19) множники, що не залежать від 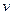 , отримаємо для знаходження
, отримаємо для знаходження  співвідношення
співвідношення
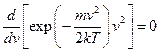 .
.
Провівши диференціювання, прийдемо до рівняння
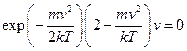 .
.
Перший множник (експонент) перетворюється в нуль при  , а третій множник (
, а третій множник ( 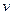 ) при
) при  . Однак з графіка бачимо, що значення
. Однак з графіка бачимо, що значення  і
і  відповідають мінімумам функції
відповідають мінімумам функції  . Отже, значення
. Отже, значення 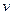 , що відповідає максимуму, отримується з рівності нулю другої дужки:
, що відповідає максимуму, отримується з рівності нулю другої дужки: 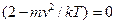 .
.
Звідки
 . (20.20)
. (20.20)
Відповідно до формул (20.10) і (20.12) середнє (за молекулами) значення модуля швидкості 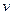 і середнє значення квадрата
і середнє значення квадрата 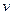 визначається виразами
визначається виразами
 ,
,
 . (20.21)
. (20.21)
Таким чином, середня швидкість молекул (її також називають середньою арифметичною швидкістю) має значення
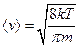 . (20.22)
. (20.22)
Корінь квадратний з виразу (20.21) дає середню квадратичну швидкість молекул:
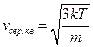 . (20.23)
. (20.23)
Помноживши чисельник і знаменник підкореневих виразів в (20.20), (20.22) і (20.23) на сталу Авогадро і пам’ятаючи, що  рівно газовій сталій
рівно газовій сталій 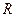 , а
, а  – молярній масі газу
– молярній масі газу 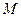 , прийдемо до результатів
, прийдемо до результатів
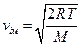 ,
, 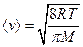 ,
,  . (20.24)
. (20.24)
Знайдемо середню швидкість молекул азоту ( 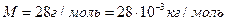 ) при кімнатній температурі (293К):
) при кімнатній температурі (293К):
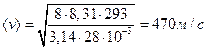 .
.
Для кисню отримується при тій самій температурі 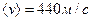 , а для водню
, а для водню 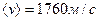 . Таким чином, молекули повітря за секунду проходять шлях, що дорівнює майже
. Таким чином, молекули повітря за секунду проходять шлях, що дорівнює майже 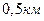 .
.
Якщо існує суміш газів, яка знаходиться у рівновазі, то в межах кожного сорту молекул має місце розподіл Максвелла зі своїм значенням  . Відповідно більш важкі молекули рухаються з меншою середньою швидкістю, чим більш легкі.
. Відповідно більш важкі молекули рухаються з меншою середньою швидкістю, чим більш легкі.
Відповідно до формули (20.7) кількість молекул, швидкості яких укладені в межах від 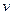 до
до  , рівна
, рівна
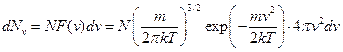 (20.25)
(20.25)
( 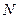 – повна кількість молекул). Цю формулу можна значно спростити, якщо перейти до відносної швидкості
– повна кількість молекул). Цю формулу можна значно спростити, якщо перейти до відносної швидкості
 , (20.26)
, (20.26)
тобто покласти 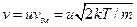 . Тоді замість
. Тоді замість 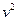 треба підкласти у (20.25)
треба підкласти у (20.25) 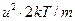 , а замість
, а замість  – вираз
– вираз  . В результаті отримаємо формулу
. В результаті отримаємо формулу
 , (20.27)
, (20.27)
де 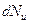 – кількість молекул, відносні швидкості яких укладені в межах від
– кількість молекул, відносні швидкості яких укладені в межах від 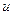 до
до  . Функція
. Функція 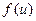 є функція розподілу ймовірності значень
є функція розподілу ймовірності значень 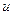 , котра має вигляд
, котра має вигляд
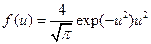 . (20.28)
. (20.28)
Цей вираз являє собою функцію розподілу Максвелла, записану в змінній 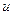 .
.
Проінтегрувавши вираз (20.27) в межах від 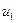 до
до  , отримаємо кількість молекул
, отримаємо кількість молекул  , відносні швидкості котрих знаходяться в цих межах:
, відносні швидкості котрих знаходяться в цих межах:
 . (20.29)
. (20.29)
В таблиці 1 наведені відносні кількості молекул  , розраховані згідно формули (20.29) для різних інтервалів швидкостей. З таблиці випливає, що у 70,7% молекул швидкість відрізняється від найбільш ймовірної не більше ніж на 50%. Швидкостями, що перевищують найбільш ймовірну більш ніж у три рази, володіють лише 0,04% молекул, а швидкості, що перевищують найбільш ймовірну більш ніж у п'ять разів, спостерігається в однієї з 12 мільярдів молекул. Ці дані підтверджують висловлене раніше твердження про те, що швидкості молекул в основному групуються поблизу найбільш ймовірного (з тим же правом можна сказати - поблизу середнього) значення.
, розраховані згідно формули (20.29) для різних інтервалів швидкостей. З таблиці випливає, що у 70,7% молекул швидкість відрізняється від найбільш ймовірної не більше ніж на 50%. Швидкостями, що перевищують найбільш ймовірну більш ніж у три рази, володіють лише 0,04% молекул, а швидкості, що перевищують найбільш ймовірну більш ніж у п'ять разів, спостерігається в однієї з 12 мільярдів молекул. Ці дані підтверджують висловлене раніше твердження про те, що швидкості молекул в основному групуються поблизу найбільш ймовірного (з тим же правом можна сказати - поблизу середнього) значення.
Згідно формулам (20.24)
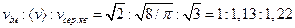 (20.30)
(20.30)
(див. рисунок 20.2). Таким чином, середня і середня квадратична швидкості більше від найбільш ймовірної швидкості на 13 і 22% відповідно. З (20.26) і (20.30) витікає, що 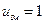 ,
,  ,
, 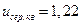 .
.
Таблиця 20.1 – Відносна доля молекул, що мають різну відносну швидкість 
|  , % , %
| 
|  , % , %
|
| 0 – 0,5 | 8,1 | 2 – 3 | 4,6 |
| 0,5 – 1,5 | 70,7 | > 3 | 0,04 |
| 1,5 – 2 | 16,6 | > 5 | 8∙10-9 |
 На рисунку 20.3 приведені графіки розподілу Максвелла для двох значень температури. Графіки можна трактувати або як відповідні різним значенням температури, або як відповідні різним значенням маси молекул. Площа, обмежена графіком, в обох випадках рівна одиниці.
На рисунку 20.3 приведені графіки розподілу Максвелла для двох значень температури. Графіки можна трактувати або як відповідні різним значенням температури, або як відповідні різним значенням маси молекул. Площа, обмежена графіком, в обох випадках рівна одиниці.
Таблиця 20.2– Значення температури
| Варіант | ||||||
| Т1, К | ||||||
| Т2, К |
Читайте також:
- I. Доповнення до параграфу про точкову оцінку параметрів розподілу
- IV. Розподіл нервової системи
- V. Розподільний диктант.
- Авоматизація водорозподілу регулювання за нижнім б'єфом з обмеженням рівнів верхнього б'єфі
- Автоматизація водорозподілу з комбінованим регулюванням
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Автоматизація водорозподілу регулювання зі сталими перепадами
- Автоматизація водорозподілу регулюванням з перетікаючими об’ємами
- Автоматизація водорозподілу регулюванням за верхнім б'єфом
- Автоматизація водорозподілу регулюванням за нижнім б'єфом
- Алгоритм розв’язання розподільної задачі
- Аналіз ефективності використання каналів розподілу
| <== попередня сторінка | | | наступна сторінка ==> |
| Функція розподілу ймовірності. | | | Послідовність виконання роботи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |