
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Заміщення атому галогену іншими замісниками.
Значна кількість галогенпохідних отримується з метою синтезу на їх основі інших продуктів шляхом заміщення атому галогену. В аліфатичному ряді реакція нуклеофільного заміщення протікає легко, в ароматичному як правило затруднена.
8.1. Реакції нуклеофільного заміщення галогену в аліфатичному ряду.
При дії галогенпохідних аліфатичного ряду різноманітних органічних або неорганічних реагентів, в склад яких входять атоми з неподіленими парами електронів, проходить заміщення галогену. Для первинних алкіл галогенідів характерні наступні реакції:
–– синтез Вюрца-Фіттіга
CH3CH2Br + С2H5– ® C2H5–C2H5 (Реакція Вюрца)
CH3CH2Br + Ar – ® C2H5–Ar (Реакція Вюрца-Фіттіга)
Синтез Вюрца-Фіттіга дозволяє отримати аліфатичні вуглеводні і гомологи бензену. Він полягає в кип’ятінні галогеналкілів або суміші галогеналкілу і галогенарилу з металічним натрієм. В тому випадку, коли в реакції Вюрца використовують два різних первинних алкіла, часто утворюється суміш, яку важко розділити, що сильно знижує препаративну цінність методу.
Реакція Фіттіга з використанням еквімолекулярних кількостей алкіл- і арилгалогеніду протікає більш однозначно через те, що арилгалогенід реагує з натрієм, з утворенням металоорганічних сполук швидше, чим алкілгалогенід.
–– синтез алкінів
CH3CH2Br + – С≡СR ® CH3CH2 –C≡CR
Реакція дозволяє ввести в органічну молекулу, з виходом 70-90%, групу –С≡СH. Отримані таким чином алкіни можуть бути використані для подальшого синтезу алкенів (гідрування) або метилкетонів (гідратація по Кучерову). Ацетиленід натрію, який в даному випадку є реагентом, отримують при взаємодії аміду натрію з ацетиленом
NaNH2 + H–C≡CH ® NaC≡CH + NH3
–– синтез Габріеля
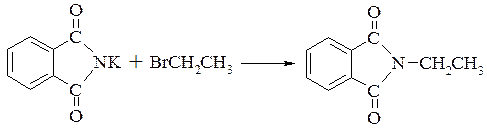
–– алкілування аміаку по Гофману
CH3CH3Br + NH3 ® CH3CH2NH2
CH3CH3Br + CH3CH2NH2 ® (CH3CH2)2NH
CH3CH3Br + (C2H5)2NH ® (CH3CH2)3N
CH3CH3Br + (C2H5)3NH ® (CH3CH2)4N+Br –
При взаємодії галоїдних алкілів з аміаком звичайно утворюється суміш первинного, вторинного і третинного галоїдних алкілів, а також четвертинної амонієвої основи. Реакція Габріеля дозволяє отримати первинні аміни без домішок. Однак заключну стадію – гідроліз N-алкілфталіміду – доводиться проводити в жорстких умовах (тривале кип’ятіння з 20%-ною соляною кислотою) або знімати фталильну групу за допомогою гідразингідрату в спиртовому розчині. Гідролізувати N-алкілфталімід безпосередньо водою вдається тільки при високих температурах під тиском.
–– синтез Вільямсона
CH3CH2Br + NaOC2H5 ® CH3CH2OC2H5
CH3CH2Br + ArONa ® Ar–O–CH2CH3
Реакція дає можливість синтезувати як несиметричні, так і симетричні прості ефіри. Звичайно спиртовий розчин попередньо отриманого алкоголяту або феноляту натрію нагрівають з галоїдним алкілом. При відсутності спирту при нагріванні суспензії алкоголята в галоїдному алкілі виходи невисокі. Феноляти реагують з більшим виходом, ніж алкоголяти.
–– лужний гідроліз
CH3CH2Br + NaOH ® CH3CH2OH
Лужний гідроліз дозволяє отримати з галоїдних алкілів відповідні спирти. Експериментально реакція проводиться при кип’ятінні галоїдного алкілу з водним розчином лугу. Деколи вдається збільшити вихід спирту, якщо піддавати гідролізу не сам галоїдний алкіл, а попередньо отриманий складний ефір карбонової кислоти. Останній метод особливо необхідно використовувати при гідролізі гем-дигалоїдпохідних, в результаті якого утворюються чутливі до лугів карбонільні сполуки.
–– синтез складних ефірів
CH3CH2Br + NaOCOCH3 → CH3CH2OCOCH3
–– заміна одного галоїду іншим (реакція Фількенштейна)
CH3CH2Br ® CH3CH2–Z
Реакції, що є обміном одного галогену на інший, використовують в основному для синтезу фтористих і йодистих алкілів з більш доступних бромистих і хлористих алкілів. Реакція отримання фтористих похідних проходить легко, так як вони мають нижчу температуру кипіння, чим вихідний галоїдний алкіл, і їх можна відганяти з реакційної маси, по мірі утворення. Отримання йодистого алкілу можливо тільки в тому випадку, якщо в якості розчинника використовувати ацетон, в якому з галогенідів лужних металів розчинний тільки йодистий натрій, а бромистий натрій, що утворюється в реакції випадає в осад.
–– синтез Кольбе
CH3CH2Br + NaCN ® CH3CH2–C≡N
Дана реакція має велике препаративне значення через те, що дозволяє з високими виходами отримувати з галоїдних алкілів нітрили кислот, і тобто, і самі кислоти, з одночасним збільшенням вуглецевого ланцюга на один атом вуглецю. При проведенні реакції необхідний багатогодинний нагрів реакційної маси.
–– синтез Мейєра-Корнблюма
CH3CH2Br + AgNO2 ® CH3CH2NO2
Реакція дозволяє отримати з галогенпохідних нітросполуки з виходом до 80%. Реакція проводиться в середовищі ефіру при кімнатній температурі. Раніше в якості реагенту використовували цінний нітрит срібла. Корнблюм показав, що для цієї реакції можна використовувати і дешевий нітрит натрію, якщо проводити реакцію в диметилформаміді. Правда вихід знижується до 60%. Поряд з нітросполукою утворюється, особливо у випадку нітриту срібла, ефір нітритної кислоти.
Для препаративних цілей дана реакція має явну перевагу над реакцією Коновалова, яка заключається в нагріванні насичених вуглеводнів з розбавленою азотною кислотою. Остання реакція протікає неселективно і супроводжується крекінгом вихідного вуглеводню. Але на виробництві використовується як раз реакція Коновалова.
–– синтез Конрада

–– синтез з ацетооцтовим ефіром, ціаноцтовим ефіром і т.п.

Реакції знаходять широке практичне застосування, при проведенні яких галоїдний алкіл вводиться в розчин похідного малонового або ацетооцтового ефіру. По реакції Конрада отримують ефіри різних моно- і діалкілмалонових кислот з виходами 75-90%, а після гідролізу і декарбоксилювання – одноосновні кислоти, які мають як нерозгалужений, так і розгалужений вуглецевий скелет.
–– реакція Делєпіна
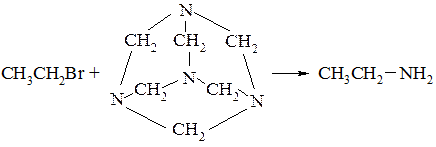
При взаємодії галоїдного алкіла з уротропіном проходить квартенізація тільки одного атому азоту; інші три атоми азоту, які входять в молекул уротропіну, при цьому втрачають свою основність і в реакцію з галоїдним алкілом не вступають. При обробці отриманої солі спиртовим розчином хлористоводневої кислоти утворюється сіль первинного аміну.
8.2. Заміна галогену в ароматичному ряду
Атом галогену в ароматичному ряді може бути заміщений на:
– групи, які містять азот
Найбільш важливими групами, котрими практично заміщається атом хлору в ароматичних сполуках є аміногрупа, ариламіногрупа і алкіламіногрупа. При взаємодії арилгалогенідів з первинними і вторинними амінами виділяється хлористий водень, для зв’язування якого використовують лужний агент (гідроксид натрію, карбонат натрію або калію, ацетат натрію і т.п.), а в деяких випадках використовують надлишок реагенту.
- заміщення аміногрупою
Обмін атому галогену на аміногрупу здійснюється звичайно нагріванням галогенпохідної ароматичної сполуки з концентрованим розчином аміаку (не менше 4 молів на 1 моль арилгалогеніда). При наявності в молекулі хлорзаміщеної сполуки груп, що збільшують рухливість атому хлору, реакція з аміаком проводиться при температурах до 200°С і під тиском до 10МПа.
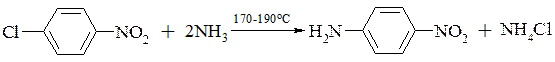

Як правило, заміщення атому хлору аміногрупою проходить з досить високим виходом (до 90% і вище).
- заміщення ариламіногрупою
Ця реакція здійснюється при взаємодії ароматичної сполуки, що містить галоген, з первинними ароматичними амінами, яка приводить до утворення вторинних ароматичних амінів.
ArCl + ArNH2 → Ar–NH–Ar + HCl
Первинні ароматичні аміни реагують з галоген похідними ароматичних сполук з меншою швидкістю, ніж аміак. Це викликано значно меншою основністю ароматичних амінів порівняно з аміаком або первинними алкіламінами, наприклад, рКа для аміаку 9,25, для метиламіну 10,62, для п-фенілендіаміну 6,3, і для п-анізідіну 5,3. Тому для заміщення атому галогену ариламіногрупою використовують галогенпохідні сполуки, в яких галоген достатньо рухливий, тобто активований електроноакцепторною групою.
За допомогою цієї реакції в промисловості отримують ряд цікавих амінодифеніламінів, що використовуються для синтезу барвників.
Х=Н, ОСН3, Y=Н
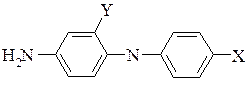
X=NH2, Y=SO3H
– групи, які містять кисень
- заміщення гідроксильною групою
Ця реакція поряд з лужною плавкою служить одним з методів отримання ароматичних гідроксисполук, наприклад фенолу.
Заміщення атому хлору в ароматичних сполуках можна здійснити двома методами, пропусканням парів хлорароматичної сполуки і води над каталізатором (парофазний гідроліз) або дією розчину гідроксиду натрію (лужний гідроліз).
При парофазному гідролізі в якості каталізаторів використовують силікагель і фосфати на пористих носіях. Активність каталізаторів може бути підвищена добавками солей міді, нікелю, срібла і т.п.
В промисловості метод парофазного отримання фенолу здійснюють при 450-500°С на каталізаторі фосфаті кальцію активованому солями міді.
Отримання фенолу по цьому методу може бути суміщено з отриманням хлорбензену окислювальним хлоруванням бензену хлористим воднем в присутності кисню повітря
2C6H6 + 2HCl + O2 → 2C6H5Cl + H2O → 2C6H5OH + HCl
При лужному гідролізі арилхлоридів кількість лугу повинна складати не менше 2 молі на 1 моль арилхлориду. Хлорбензен реагує з NаОН при температурі вище 300°С, а 1,3-динітро-4-хлорбензен перетворюється в 2,4-динітрофенол вже при кип’ятінні з водним розчином гідроксиду натрію при атмосферному тиску.
- заміщення алкоксигрупою
Цю реакцію звичайно використовують для отримання алкілових ефірів нітрофенолів і здійснюють при дії відповідного спирту на нітрохлорбензени в присутності лугу.

Взаємодію хлорзаміщених зі спиртовим розчином лугу проводять з використанням надлишку спирту. Надлишок спирту, зменшує концентрацію води в реакційній масі, зсуває рівновагу вправо, в сторону утворення алкоксиду натрію, що сприяє зменшенню побічного утворення гідроксисполуки. Гідроксид натрію беруть в кількості, яка близька до теоретично необхідної. Реакцію нітрохлорбензенів зі спиртовими розчинами лугу проводять звичайно при нагріванні до 90-100°С, при невеликому тиску (біля 0,3МПа).
Найбільший практичний інтерес представляє отримання цим методом о- і п-нітроанізолів і п-нітрофенетолу, які використовують для отримання відповідно о-анізидину і діанізидину, п-анізидину, п-фенітидіну.
Для отримання о-нітроанізолу до розчину о-нітрохлорбензену в метанолі, нагрітому до 90-95°С, поступово добавляють 13,5%-ний розчин NаОН в метанолі. По закінченні реакції надлишок лугу нейтралізують сірчаною кислотою і відганяють спирт. Залишок розбавляють водою і відділяють о-нітроанізол.
- заміщення арилоксигрупою
Заміщення арилоксигрупою атому галогену використовують для отримання дифенілового ефіру і його заміщених. Дифеніловий ефір може бути отриманий при взаємодії хлорбензену з феноксидом натрію в присутності міді при 200°С або як побічний продукт в виробництві фенолу лужним гідролізом хлорбензену.
В сполуках, які містять нітрогрупу в о-, п-положеннях до атому галогену, заміщення арилоксигрупою йде при відсутності каталізатора. Так при тривалому нагріванні о-нітрохлорбензену з фенолятом натрію (невеликий надлишок) в фенолі при 95-105°С отримують 2-нітродифеніловий ефір, при відновленні якого утворюється амін, що використовується для синтезу барвників.

- заміщення атому хлору в бічному ланцюзі
Атом хлору в бічному ланцюзі дуже рухомий і легко заміщується. Відомо, що бензилхлорид гідролізується в 200 разів швидше, н-алкілхлориди. Найбільший інтерес представляють бензилхлорид, бензиліденхлорид і бензотрихлорид, які перетворюються відповідно в бензиловий спирт, бензальдегід і бензойну кислоту.
Гідролізом бензилхлориду при нагріванні з 15%-ним розчином соди при 135-138°С в промисловості отримують бензиловий спирт. Для отримання бензальдегіду використовують гідроліз бензіліденхлориду розбавленою сірчаною кислотою при 60-90°С.



Ароматичні вуглеводні, які містять трихлорметильну групу, порівняно легко гідролізуються як в кислому, так і в лужному середовищі. Продуктом вичерпного гідролізу є бензойна кислота. Однак отримання бензойної кислоти цим шляхом на даний час недоцільно, так як метод її отримання окисленням толуену значно економічніший.
Гідроліз трихлорметилбензенів в кислому середовищі можна зупинити на стадії утворення хлорангідриду ароматичної карбонової кислоти. Перетворення здійснюють придачею розрахункової кількості води в присутності каталізатора (хлорид цинку, мінеральні кислоти), який беруть в кількості 0,1-1% від маси трихлорметильного заміщеного, реакція легко протікає при 80-100°С і атмосферному тиску. Вихід бензоїлхлориду складає 85%.
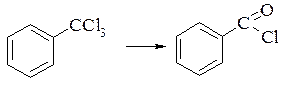
Читайте також:
- Аналогія - спосіб отримання знань про предмети та явища на основі їхньої подібності з іншими.
- Аудит операцій з основними та іншими необоротними активами
- Бюджетний устрійпоказує, в який спосіб побудована бюджетна система. Іншими словами,він відображає організацію вертикальної структури бюджету держави за рівнями влади.
- Верховна Рада України: структура, функції, порядок формування та взаємодії з іншими органами влади.
- Взаємне заміщення аміно- і гідроксисполук
- Взаємодія ДСМК з іншими аварійно-рятувальними службами.
- Взаємодія СВА з іншими структурними підрозділами підприємства.
- Взаємодія структур маркетингу з іншими
- Взаємозв'язок географії туризму з іншими науками
- Взаємозв'язок соціології з іншими науками
- Взаємозв’язок бюджету з іншими фінансовими планами
- Взаємозв’язок етики з іншими науками, що вивчають мораль
| <== попередня сторінка | | | наступна сторінка ==> |
| Заміщення сульфогрупи гідроксильною групою і іншими замісниками | | | Взаємне заміщення аміно- і гідроксисполук |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |