
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СИЛА КИСЛОТ І ОСНОВ.
По визначенню Арреніуса, кислоти – це сполуки, які в розчині дають іони водню, тоді як основи утворюють іони гідроксилу. Силу кислоти HX у воді, тобто ступінь її дисоціації, можна визначити, розглядаючи рівновагу:
H2O + HX ↔ H3O+ + X-
Константа рівноваги виражається рівнянням:
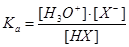 ,
,
де концентрація води є величиною постійною, так як вода виступає середовищем. Для зручності подання замість величини константи дисоціації подають її логарифм.
Вплив середовища на дисоціацію кислот і основ може бути значним. Так, соляна кислота, яка у водному середовищі є сильною кислотою, в бензолі практично не дисоціює.
Кислотність органічних сполук залежить від:
– міцності зв’язку H–X;
– від електронегативності X;
– від природи розчинника;
– від факторів, які стабілізують X-;
Перший фактор незначно впливає на кислотність, так як він не лімітує процес в цілому. Другий фактор значно впливає на константу дисоціації. Так, для метанолу рК=16, а для мурашиної кислоти 3,8. Таке збільшення кислотності в першу чергу пояснюється наявністю карбонільної групи. Однак, ще більше значення має стабілізація форміат-аніона за рахунок делокалізації від’ємного заряду. У випадку аліфатичних спиртів фактор стабілізації аніона відсутній, через що такі спирти значно менш кислі. Але у випадку фенолу є можливість стабілізації фенолят-аніона за участю π-орбіталей ароматичного кільця. І дійсно, константа дисоціації фенолу 9,95.
Введення замісників в молекулу мурашиної кислоти повинно приводити до зміни величини константи дисоціації. При введенні в молекулу електронодонорних замісників понижується спорідненість атома кисню до електрона, і, як наслідок, знижується кислотність (для оцтової кислоти 4,76). Подальше збільшення розміру алкільного замісника вже незначно буде впливати на кислотність (для пропіонової кислоти 4,88). При введенні електроноакцепторних замісників спостерігається підвищення кислотності, що пов’язують зі зміщенням електронної густини на замісник і підвищенням стабільності аніона. рК для фтороцтової кислоти 2,66, для нітрооцтової 1,68.
Подібна картина спостерігається і у випадку похідних фенолу. Введення електронодонорних замісників знижує константу кислотності фенолів, але таке зниження незначне. рК для п-метилфенолу 10,2. Більш суттєво впливають на кислотність електроноакцепторні замісники. рК для п-нітрофенолу 7,1. В даному випадку спостерігається зміна інтенсивності впливу замісника в залежності від його розміщення. Більш значний вплив мають замісники в орто- і пара-положеннях, менший в мета-положенні. рК о-нітрофенолу 7,2, м-нітрофенолу 8,35.
Так як бензольне ядро є електроноакцепторним замісником у випадку бензойної кислоти спостерігається деяке підвищення кислотності (рК 4,2). Як і для фенолів введення електронодонорних замісників у бензольне ядро незначно підвищує кислотність похідних бензойної кислоти (рК п-метилбензойної кислоти 4,34). Введення електроноакцепторних замісників підвищує кислотність (рК п-нітробензойної кислоти 3,43). Замісник в орто-положенні до карбоксильної групи часто аномально впливає на кислотність (рК саліцилової кислоти 3,0), що пов’язують з виникненням водневого зв’язку, який стабілізує аніон.
Силу основи у воді можна оцінити розглядаючи рівновагу:
R3N + H3O+ ↔ R3NH + OH-
В такому випадку константа рівноваги у воді виражається рівнянням:
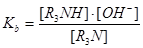
Концентрацію води можна вважати постійною, оскільки вона присутня у великому надлишку. Силу основ можна також виражати через рКа, маючи таким чином, неперервну шкалу для кислот і основ.
рКа + рКb = 14,0 (при 25ºС).
Для аліфатичних амінів підвищення сили азотистої основи пов’язано з наростаючою можливістю приєднувати протон, тобто зі здатністю надавати електронну пару азоту. Тоді можна очікувати, що основність зростає в ряді NH3 > RNH2 > RNH > R3N, як результат підвищення індуктивного ефекту за рахунок введення алкільних груп. pКb аміаку 4,75, метиламіну 3,36, диметиламіну 3,23, триметиламіну 4,2. Введення третьої метильної групи не приводить до збільшення основності, що пов’язують зі зменшенням кількості водню, які можуть гідратуватися у водних розчинах. Основність амінів в неводних розчинах через відсутність гідратування зростає в приведеній послідовності. Гідроксид четвертинного алкіламонію по силі одного порядку з мінеральними лугами, що пов’язують з повною іонізацією їх у водному розчині.
Введення електроноакцепторних груп приводить до пониження основності аміну. Так введення трьох трифторметильних груп приводить до такого зниження основності, що така сполука вже не являється основою. Аналогічна ситуація спостерігається, якщо аміногрупа безпосередньо зв’язана з карбонільною групою. Тоді вільна пара електронів азоту вступає в спряження з подвійним зв’язком, що приводить до різкого падіння основності. Так, фталімід не тільки не проявляє основних властивостей, але є швидше кислотою і достатньо легко дає солі з лужними металами.
Подібна картина спостерігається у випадку аніліну (рКb 9,38), в якого вільна електронна пара вступає у спряження з ароматичним ядром. Коли ж до атома азоту приєднається протон, таке спряження енергетично невигідне, тобто анілін буде проявляти низьку основність.
Той факт, що мезомерна дестабілізація катіона аніліну порівняно з молекулою аніліну суттєво не впливає на основність аніліну, підтверджується відносно незначним і нерегулярним ефектом, яке викликає введення метильних груп в аміногрупу або в бензольне кільце, на величину константи основності. Незначний позитивний індукційний ефект, який викликають метильні групи, недостатній для того щоб відчутно дестабілізувати катіон аніліну. Групи, які мають суттєвий негативний мезомерний ефект викликає значні зміни в основності. Нітрогрупа, що знаходиться в орто- або пара-положеннях, взаємодіє з неподіленою парою електронів азоту і делокалізація π-електронів ароматичного кільця посилюється. При цьому катіон дестабілізується ще більше, що приводить до подальшого падіння основності (рКb п-нітроаніліну 13,02). Збільшення кількості нітрогруп приводить до того, що тринітроанілін (пікрамінова кислота) легко гідролізується і веде себе як кислота. В той же час N,N-диметилтринітроанілін (рКb 4,8) сильна основа, що пов’язується з порушенням компланарності молекули і, як наслідок, порушенням спряження. Введення електронодонорних замісників в молекулу аніліну приводить до підвищення основності амінів (рКb п-амінофенолу 8,5).
Читайте також:
- Альдегід Реактив Толенса Кислота
- Білки – це високомолекулярні органічні біополімери, мономерами яких є амінокислоти.
- БІОСИНТЕЗ АМІНОКИСЛОТ
- БІОСИНТЕЗ ЖИРНИХ КИСЛОТ
- Біотехнологічне виробництво незамінних амінокислот
- Визначення золи, нерозчинної у хлороводневій кислоті
- Визначення реакції продуктів, кислотності і лужності.
- Винна кислота
- Властивості оксокислот хлора
- Вміст незамінних амінокислот у їжі
- Вуглекислотні вогнегасники ВВ-2 та ВВ-5
- Вуглекислотні Огнегасники ВВ-2 та ВВ-5
| <== попередня сторінка | | | наступна сторінка ==> |
| ТИПИ МЕХАНІЗМІВ РЕАКЦІЙ. | | | ЕНЕРГЕТИКА І КІНЕТИКА РЕАКЦІЙ. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |